News Detail
 来源:本站
来源:本站
 浏览量:11849
浏览量:11849
EGFR(EpidermalGrowth Factor Receptor)是上皮生长因子(EGF)细胞增殖和信号传导的受体。EGFR属于受体磷酸激酶(ReceptorTyrosine Kinases, RTK)HER 家族的四个成员之一,该家族包括EGFR (ErbB-1),HER2/(ErbB-2),Her3(ErbB-3) 和Her4(ErbB-4)。研究表明,EGFR突变或过表达会引发肿瘤[1-2]。
人EGFR基因位于第7号染色体p13-q22区,全长200 kb,由28个外显子组成[3]。 EGFR是一种糖蛋白,属于酪氨酸激酶型受体,细胞膜贯通,分子量170KDa。EGFR广泛分布于哺乳动物上皮细胞、成纤维细胞、胶质细胞、角质细胞等细胞表面,EGFR信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用[4]。
EGFR的结构及生物学功能介绍
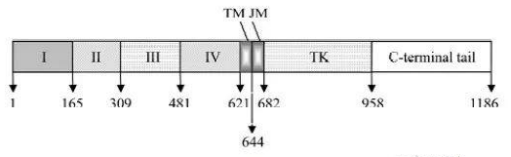
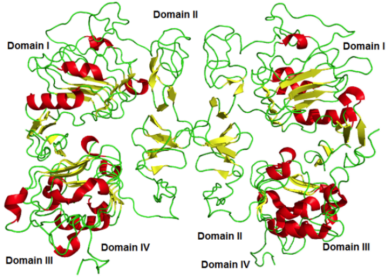
穿膜结构域(TM)是由23个氨基酸残基构成螺旋状结构的疏水区域,跨膜区锚定在细胞膜上。
胞内结构域(JM、TK、C端)是具有蛋白激酶结构域的细胞质内羧基端区域,共542个氨基酸残基,包含了3个子区域,分别是酪氨酸激酶区(TK),近膜区(JM)和C端末区(CTD)。酪氨酸激酶区有ATP结合位点,在EGFR与配体结合发生二聚化后,ATP与位点结合,激活下游信号通路。近膜区能够调节激酶二聚化,对下游信号通路有调节作用。C端末区在EGFR被激活时,发生自身磷酸化,磷酸化残基募集活化细胞内的信号转导途径[7-8]。
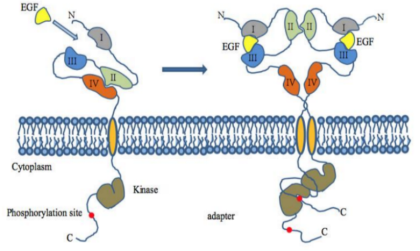
图1.3 EGFR通过EGF配体激活形成二聚体流程示意图[10]
EGFR受体可激活三个信号通路[11]:参与免疫调节的JAK/STAT信号通路,参与细胞增殖的RAS-RAF-MEK途径(MAPK/ERK通路),以及参与细胞存活的PI3K-AKT-mTOR途径(图1.4)。RAS-RAF-MEK途径负责控制基因转录活动和细胞循环周期,而PI3K-AKT-mT0R途径可激活抗细胞凋亡的信号。因此,EGFR受体蛋白在细胞增殖及存活上有着非常重要的作用。三种信号通路是细胞内信号转导的基础,调控肿瘤细胞诸多生理变化如:分裂、分化、生长以及迁移等。
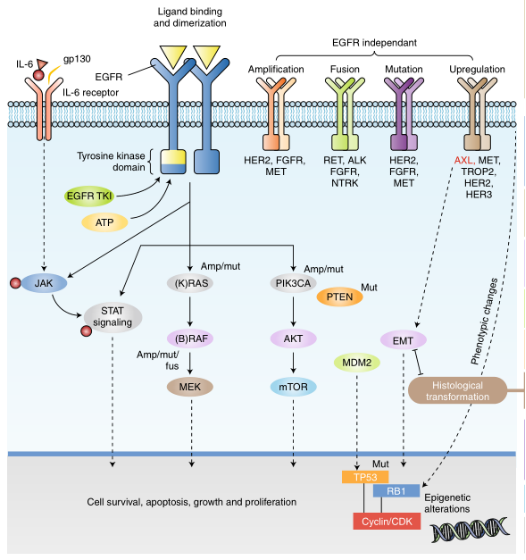
EGFR过度表达,会激活下游信号通路,使得细胞生长无法抑制,肿瘤细胞增殖、转移等特性得以增强,最终促使肿瘤病变的发生[12]。
EGFR与肿瘤的关系和靶向药物研究进展
1980 年,研究者发现 EGFR 和 V-ERBB 之间高度同源,后者是一种病毒蛋白[13]。同时期从大鼠肿瘤中分离出属于 Erbb 基因家族的 Neu 促癌基因,发现在其跨膜结构域中存在单点突变[14]。这两份研究第一次发现了 EGFR 和癌症之间的关系。通过细胞和小鼠诱导 EGFR 过表达实验,证明 EGFR 可以促进癌细胞的增殖和转化并发展出相关肿瘤 [15] 。临床标本中也发现,在肺癌、食管癌和结直肠癌中存在 EGFR 基因过表达 [16] 。
EGFR与33%~50%的人类上皮肿瘤相关。乳腺癌、膀胱癌、肺癌及前列腺癌等许多恶性肿瘤中都发现有EGFR的过度表达,这说明EGFR在肿瘤细胞的恶性增殖中起重要作用。在大部分人类脑肿瘤中,EGFR基因都存在扩增或重排,由此产生的EGFR的过度表达在这些肿瘤的发生和发展中起重要作用 [17]。
通过对 EGFR 结构和调节机制研究了解,所研发的靶向 EGFR 的抗肿瘤药物可分为两大类,分别是单克隆抗体与小分子激酶抑制剂。
单克隆抗体包括西妥昔单抗(Cetuximab)、帕尼单抗(Panitumumab)、马妥株单抗(Matuzumab)等。这三种单克隆抗体的抗原表位都在EGFR 的 III 结构域上,通过与EGFR胞外域的结合阻断配体与 EGFR 结合,从而阻止了下游通路的激活[18]。
小分子激酶抑制剂包括第一代EGFR-TKI靶向药物厄洛替尼、吉非替尼等,针对EGFR的黄金突变,即EGFR基因的19号外显子缺失突变(delE746-A750)和21号外显子的点突变(L858R)拥有良好的治疗效果。第二代EGFR-TKI靶向药物达克替尼、阿法替尼等,由于疗效较一代药物并未出现显著提升,且副作用更大,因此临床应用并不广泛。第三代EGFR-TKI靶向药物奥希替尼、艾维替尼等,已被作为EGFR敏感突变和T790M耐药突变NSCLC的治疗。他们是三磷酸腺苷(ATP)类似物,通过阻断胞内结构域的磷酸化来阻断信号通路的激活[18]。
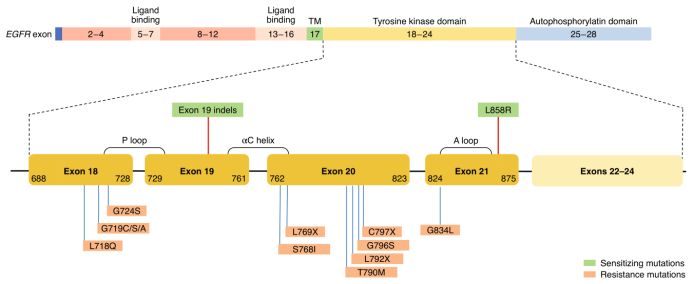
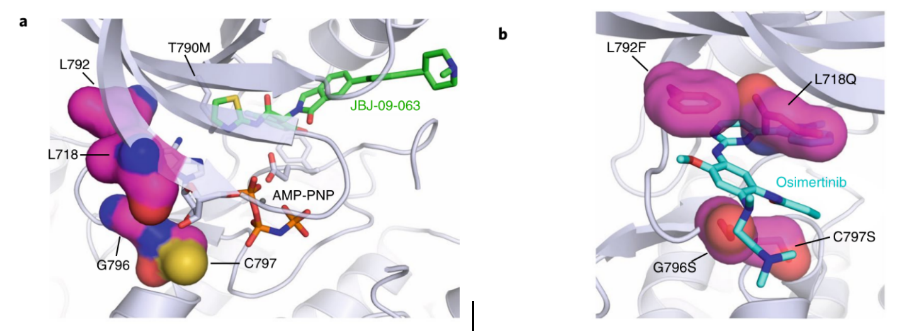
近十年来,以表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)为代表的分子靶向治疗,为癌症的治疗带来了巨大的变革,但EGFR-TKI的耐药性始终是一个悬而未决的难题。例如,EGFR-TKI在携带有EGFR突变的非小细胞肺癌(NSCLC)患者中一开始是有效的,但常演变为获得性耐药而失去治疗作用,如导致第一/二代EGFR-TKI耐药的T790M突变和导致第三代EGFR-TKI耐药的C797S突变等,尤其是同时含有L858R/T790M/C797S突变的肿瘤,目前已有的EGFR-TKI对其束手无策。
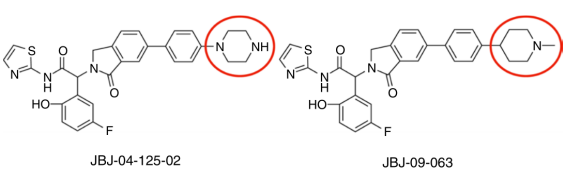
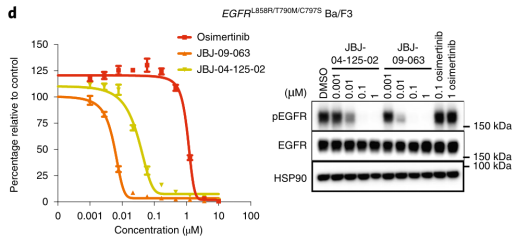
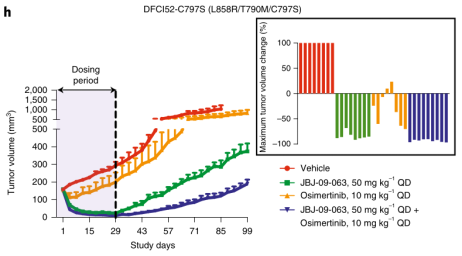
上一条:【会议预告】爱思益普邀您参加“必由之路”--新药创始人俱乐部第七届年会及“凝神聚力,创药蓝海”--CNS创业社第一届年会

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



