News Detail
 来源:2024-08-30 13:34:14
来源:2024-08-30 13:34:14
 浏览量:18928
浏览量:18928

一、爱思益普细胞生物学团队介绍
爱思益普,拥有人数100+、10年以上丰富经验的细胞学团队。可以提供包括小分子,PROTAC,ADC,抗体药在内的各类药物的检测筛选服务,擅长做各类方法开发及机制探索,合作方式及检测手段灵活多样,紧跟药物研发前沿动态,为客户提供专业高效的各类服务。
二、爱思益普体外免疫筛选平台介绍
爱思益普拥有一支专业的免疫团队,搭建了多元化的体外免疫筛选服务平台,包括已经构建的常规筛选检测以及根据特定需求优化构建的各种免疫测试服务。可以提供基本各种原代细胞的筛选测试模型,如各类种属(人,小鼠,大鼠,犬,猴子等)PBMC以及分离的各类T细胞,B细胞,NK细胞,单核细胞,粒细胞,小胶质细胞,骨髓细胞等,也包括诱导分化的DC, 巨噬细胞,Treg等,样本来源可以是健康或者患者的特殊样本,包括全血,组织等,可以满足各种免疫测试需求,更好的评价药物的体外药效及作用机制。由于免疫相关实验的多样性和复杂性,基于实验目的,我们还提供针对特定需求的实验方法开发和优化,可以最大程度帮助客户找到合适的筛选和评价体系。
三、引言
在生物进化的漫长历程中,生物体发展出了一套抵御外来病原体的侵袭的防御系统—免疫系统。免疫系统是我们健康的守护者,它监视着体内环境,识别外来的病原体等“异己”成分,发挥防御作用,清除“异己”。同时,免疫系统还肩负着清除损伤老化细胞、维护身体稳态的重要任务。固有免疫系统,作为这一系统的基础,为我们提供了一种快速的、非特异性的防御机制,它在抵御病原体和促进后续适应性免疫反应中发挥着至关重要的作用。固有免疫的核心在于它的快速响应能力。它通过一系列复杂的细胞和分子事件,迅速识别并中和入侵者。自然杀伤(NK)细胞、巨噬细胞、树突状细胞以及多种细胞因子和补体系统都是固有免疫的关键组成部分。它们协同工作,形成一张保护网,保护我们的身体免受感染和疾病的侵害。固有免疫系统的失调与多种疾病,包括自身免疫疾病、慢性炎症性疾病和癌症等,都有着密切的联系。固有免疫系统的复杂性在于它能够通过多种机制感知和响应外界威胁。其中,模式识别受体(PRRs)是固有免疫系统中的关键分子,它们能够识别病原体特有的分子模式,从而激活细胞内的信号通路,引发免疫应答。在这些PRRs中,STING信号通路因其在调控天然免疫和塑造适应性免疫反应中的独特作用而备受关注。STING是一种位于内质网的跨膜蛋白,它在感知到细胞质DNA时被激活,尤其是在病毒感染或DNA损伤时释放的DNA片段。STING的激活触发了一系列级联反应,导致干扰素和炎症细胞因子的产生,这些分子对于控制感染和激活适应性免疫系统至关重要。随着研究的深入,STING信号通路在促进宿主防御和调节免疫反应中的作用逐渐被揭示。了解STING通路的激活机制、调控因素及其与其他免疫信号通路的相互作用,对于我们开发新的疫苗和治疗药物具有重要意义。此外,STING信号通路的异常激活与自身免疫性疾病和炎症性疾病的发生发展有关,这为疾病的诊断和治疗提供了新的视角。
四、cGAS-STING通路的激活
脊椎动物细胞内DNA的主要传感器是环化GMP-AMP合成酶(cGAS)。cGAS是一种约520个氨基酸组成的蛋白质,含有一个高度碱性的约160个氨基酸组成的氨基末端(N -末端)和一个球形结构。cGAS的催化结构域由一个两瓣(lobe)结构域和一个氨基末端结构域组成。cGAS以序列无关的方式结合双链DNA(dsDNA)的糖磷酸骨架,导致结构重排激活GTP和ATP生成环化GMP-AMP(cGAMP)。cGAMP迅速扩散到整个细胞,并与内质网(ER)上的干扰素基因激活剂(STING)跨膜蛋白结合。cGAMP与STING的结合导致STING构象改变,暴露出结合位点,用于结合tank结合激酶1 (TBK1)和转录因子干扰素调节因子3(IRF3)。IRF3经历TBK1介导的磷酸化、二聚化和核转位,以激活IFN基因。除了激活IFNs外,STING还与NF-kB转录因子结合,诱导促炎症细胞因子和趋化因子的表达。
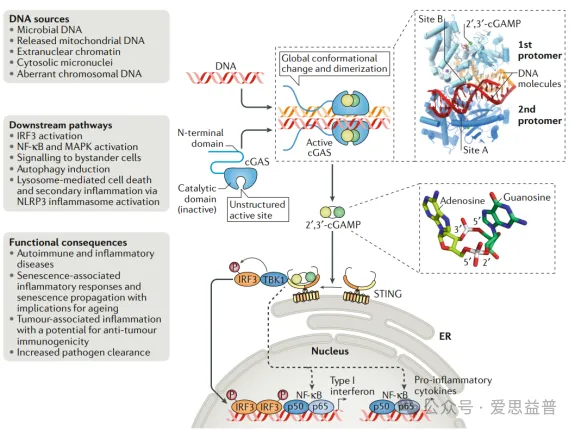
图1. 经典cGAS-STING信号通路
图源Hopfner KP, Hornung V. Molecular mechanisms and cellular functions of cGAS-STING signalling. Nat Rev Mol Cell Biol. 2020 Sep;21(9):501-521. doi: 10.1038/s41580-020-0244-x. Epub 2020 May 18. PMID: 32424334
cGAS催化DNA生成GMP-AMP(cGAMP),cGAMP结合STING蛋白,激活下游信号通路。STING是一种内质网跨膜蛋白,静息状态下,位于内质网膜上的STING以二聚体的形式存在,其配体结合域形成一个V形的口袋,可容纳环状双核苷酸配体。当配体与STING结合时,STING二聚体构象改变被激活,被激活的STING转位到高尔基体,并进一步活化TBK1(TANK-binding kinase 1)。激活后的TRK1磷酸化CTT(STING C-terminal tai)的Ser366,招募并磷酸化IRF3(干扰素调节因子3),磷酸化的IRF3形成同源或异源二聚体,然后迁移到细胞核中。活化的IRF3结合到干扰素刺激反应元件(ISREs)上,从而激活多种干扰素β(IFN-β)和其他干扰素刺激基因(ISGs)的表达。新产生的干扰素β通过自分泌或旁分泌的方式作用于相同或邻近的细胞,通过与干扰素受体结合,引发JAK-STAT信号通路,进一步促进ISGs的表达,建立起有效的抗病毒状态。STING的激活还可能通过其他途径,如NF-κB途径,促进炎症细胞因子的表达,从而招募和激活更多的免疫细胞,增强机体对病原体的清除能力。
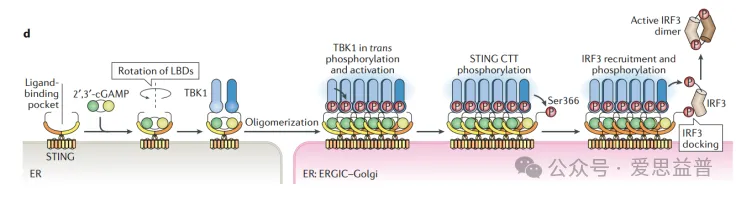
图2. cGAS-STING信号通路活化流程
图源Hopfner KP, Hornung V. Molecular mechanisms and cellular functions of cGAS-STING signalling. Nat Rev Mol Cell Biol. 2020 Sep;21(9):501-521. doi: 10.1038/s41580-020-0244-x. Epub 2020 May 18. PMID: 32424334.
五、cGAS-STING的药物研究现状
近年来,随着对这一信号通路在疾病中作用的深入理解,sGAS-STING已成为药物研发的热点靶点。目前针对cGAS-STING通路的药物主要分为以下三类:1)cGAS抑制剂:目前,文献报道的cGAS抑制剂大都存在细胞活性弱、代谢性质差等缺点,这限制了它们作为候选药物的临床有效验证。仅有少数cGAS抑制剂进入临床试验阶段,其中VENT-03已经进入临床I期试验阶段。2)STING激动剂:STING激动剂可以直接与STING蛋白结合,模拟cGAMP的作用,促进其与下游信号分子的相互作用。3)STING拮抗剂:由于sGAS-STING信号通路的异常激活与自身免疫性疾病和慢性炎症性疾病相关,STING拮抗剂的开发对于治疗这些疾病具有潜在价值。截至目前,针对STING靶点的药物研究取得了显著进展,共有81种药物被鉴定出来,这些药物针对26种不同的疾病适应症。全球有74家不同的研究机构参与了这些药物的研发工作。在临床研究方面,已有50项临床试验与STING靶点药物的开发相关联。此外,STING靶点药物的研究和开发受到了极大的关注,目前已提交了超过11647项与STING靶点药物相关的专利申请,显示了该领域的创新活跃度。在科研领域,已有5294篇科学文献发表,进一步证明了STING靶点药物研究的科学重要性和知识积累的深度。在STING靶点药物的研发赛道上,默克公司的MK-1454和ImmuneSensor公司的IMSA-101处于行业领先地位,它们已经成功推进至临床试验的第二阶段。与此同时,中国生物制药、GSK(葛兰素史克)和CS-Bay等公司也在这个领域展现出激烈的竞争态势,各自开发了4种针对STING靶点的药物。这些公司的药物研发进展标志着STING靶点治疗领域的活跃和竞争性,同时也反映了全球范围内对创新免疫疗法的迫切需求和快速发展。
六、爱思益普 cGAS-STING筛选平台介绍
1. cGAS-STING及ENPP1抑制剂生化检测平台:
ENPP1(Ectonucleotide pyrophosphatase / phosphodiesterase 1)是cGAMP的主要水解酶,其通过调节细胞外cGAMP的水平可以减弱cGAMP-STING介导的信号通路,从而调节炎症反应。相反的,抑制ENPP1可以阻断cGAMP的降解,从而恢复对肿瘤细胞的监测和清除,使其成为一种癌症治疗的潜在策略。
爱思益普已经构建了针对cGAS,STING及ENPP1的酶学检测,用于早期抑制剂抑制活性的检测,如下:
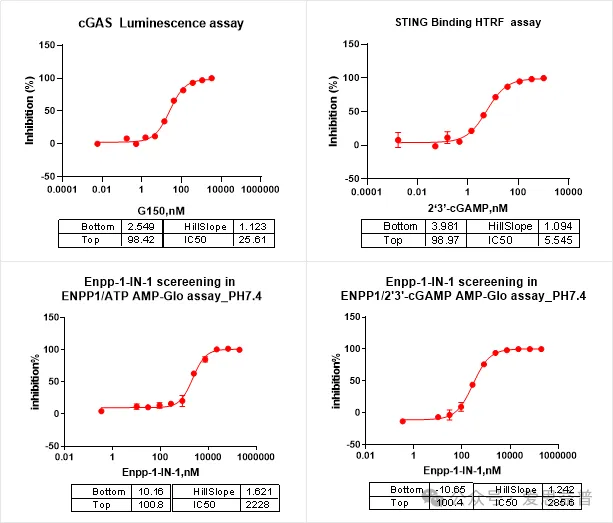
图3. cGAS-STING信号通路的激动剂/抑制剂的酶学检测
2. cGAS-STING激动剂/拮抗剂细胞学检测平台:
通过高通量筛选方式,在细胞水平进行检测,可以有效地筛选具有潜在活性的候选药物。爱思益普已经构建出具有R232突变型STING的相关的报告基因细胞,可以有效地用于高通量筛选信号通路相关抑制剂,包括cGAS抑制剂,STING激动剂及拮抗剂等。
cGAS 激动剂/抑制剂:
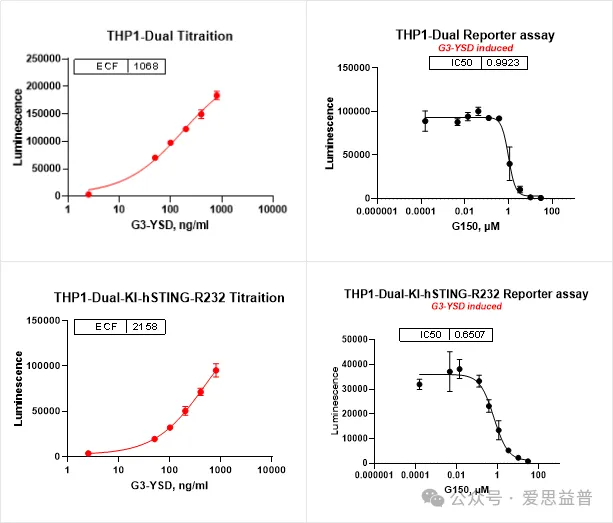
图4. cGAS激动剂/抑制剂的Reporter assay(报告基因)测试
STING激动剂:
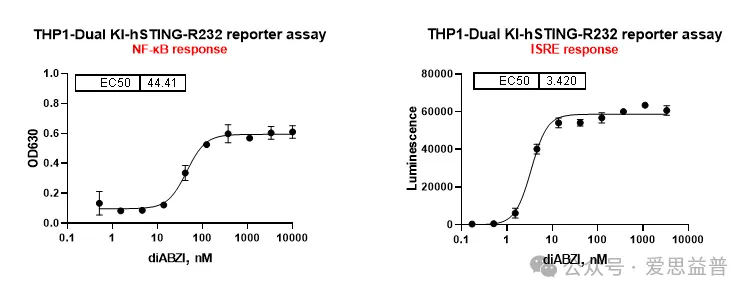
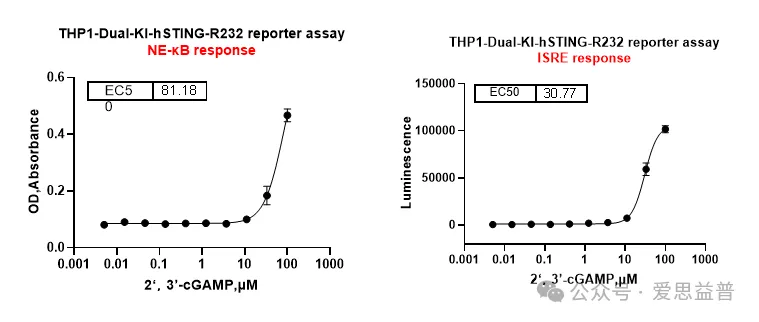
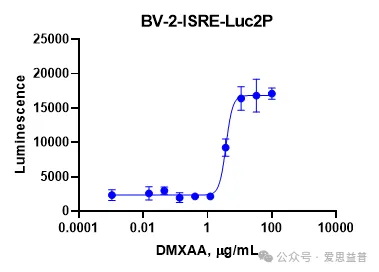
图5. 针对STING激动剂的Reporter assay(报告基因)测试
STING拮抗剂:
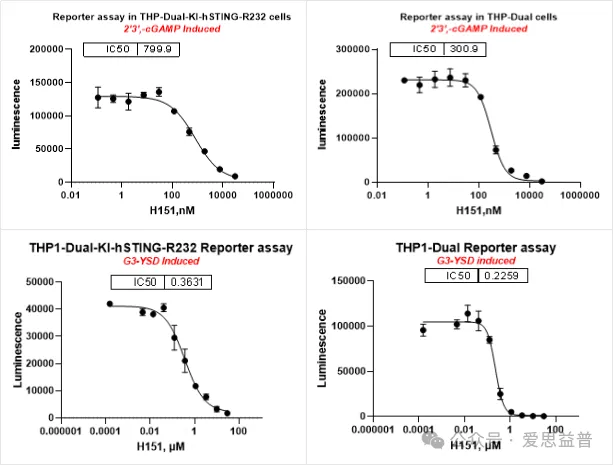
图6. 针对STING抑制剂的Reporter assay(报告基因)测试
2.2细胞功能性检测
2.2.1 原代细胞检测
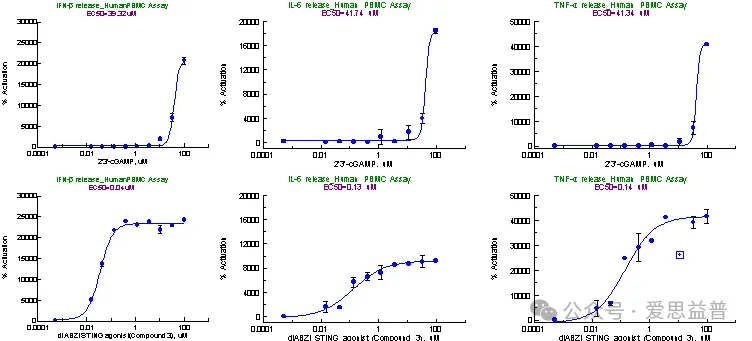
图7. 原代细胞中cGAS-STING信号通路下游细胞因子检测
2.2.2 下游细胞因子释放检测:
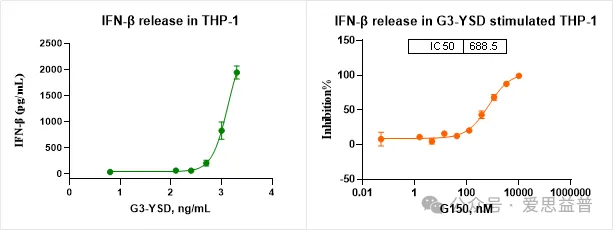
图8. 细胞系中cGAS-STING信号通路下游细胞因子检测
2.2.3 STING KO细胞系及下游基因检测:
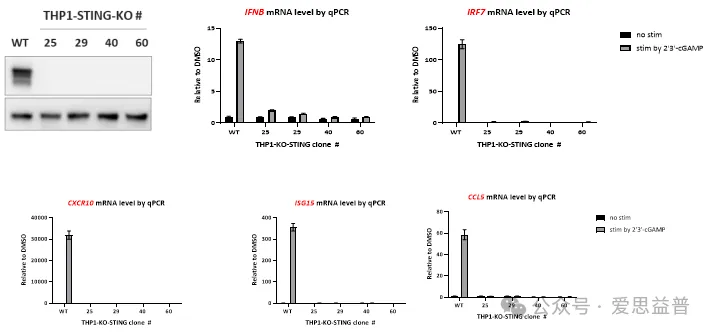
图9. STIN-KO细胞系的构建以及下游靶基因的检测
cGAS-STING通路在免疫学和细胞生物学领域的重要性日益凸显,为我们理解免疫反应、病毒感染、肿瘤免疫、自身免疫性疾病以及细胞健康维护提供了深刻的见解。这一通路不仅在抗病毒防御中发挥着至关重要的作用,还在肿瘤监测和治疗中具有潜在价值。此外,cGAS-STING通路还与细胞衰老过程相关,对于维持细胞健康至关重要。在未来,研究cGAS-STING通路的前景非常广阔。深入了解这一通路的分子机制和调控将有助于开发新的免疫疗法、抗病毒药物和肿瘤治疗策略。同时,我们也可以更好地理解自身免疫性疾病的发病机制,并为相关疾病的治疗提供新的思路。作为一家致力于前沿科学研究的公司,爱思益普拥有广泛的科研资源和专业知识,可以为cGAS-STING通路的研究提供有力支持。目前本公司针对cGAS-STING提供丰富的检测,包括酶学上的酶活水平筛选,细胞水平上有用于快速检测的报告基因实验,也有用于更详细深入的细胞因子功能检测以及其他实验。我们欢迎您垂询,共同探索这一领域的研究机会,为推动科学进步和医学应用贡献力量。
撰稿人——林江韬,赵艺晓
参考文献
1) Takeuchi O, Akira S. Pattern recognition receptors and inflammation. Cell. 2010 Mar 19;140(6):805-20.
2) Hopfner KP, Hornung V. Molecular mechanisms and cellular functions of cGAS-STING signalling. Nat Rev Mol Cell Biol. 2020 Sep;21(9):501-521. doi: 10.1038/s41580-020-0244-x. Epub 2020 May 18. PMID: 32424334.
3) Ou L, Zhang A, Cheng Y and Chen Y (2021) The cGAS-STING Pathway: A Promising Immunotherapy Target. Front. Immunol. 12:795048. doi: 10.3389/fimmu.2021.795048
4) Jungo Kato, Camilla I. Svensson,Chapter Nine - Role of Extracellular Damage-Associated Molecular Pattern Molecules (DAMPs) as Mediators of Persistent Pain, Editor(s): Theodore J. Price, Gregory Dussor,Progress in Molecular Biology and Translational Science,Academic Press,Volume 131,2015,Pages 251-279,ISSN 1877-1173,ISBN 9780128013892,
