News Detail
 来源:2024-10-21 10:10:02
来源:2024-10-21 10:10:02
 浏览量:20586
浏览量:20586

一、磷酸酶背景介绍
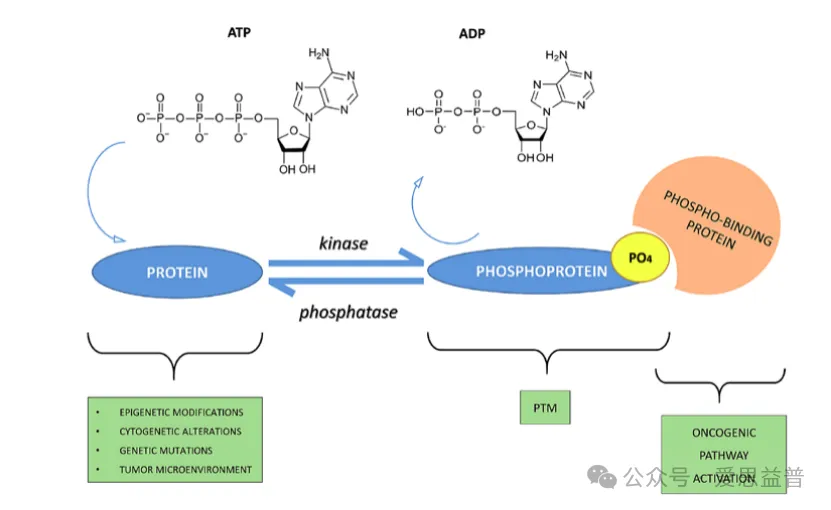
图1 磷酸化信号网络图[1]
二、磷酸酶分类
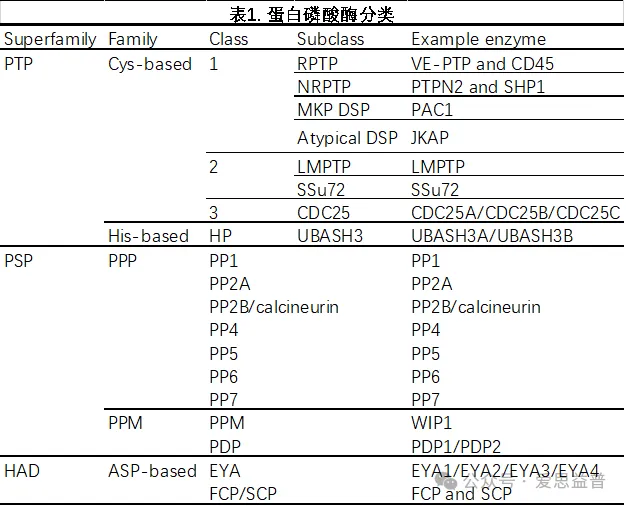
目前,文献报道人类基因组包含189蛋白磷酸酶基因[4]。根据磷酸酶催化机理不同,可分为三个磷酸酶超家族:PTP (protein tyrosine phosphatase, 酪氨酸磷酸酶), PSP(丝/苏氨酸磷酸酶)和HAD (haloacid dehalogenase,卤代酸脱卤酶),如表1所示。值得注意的是根据催化底物不同:PTP或PSP超家族中的一些磷酸酶分别在Tyr或Ser/Thr残基上脱磷酸化,而一些HAD磷酸酶使Ser/Thr或Tyr残基去磷酸化;其他磷酸酶如PTEN和RNGTT可以使非蛋白质底物去磷酸化,如脂质和核酸。
PTP蛋白只含有一个亚基,催化结构域外的其他结构域决定调节机制、亚细胞定位和底物特异性[5]。PTP按参与亲核底物攻击的主要催化残基分类包含Cys-based和His-based家族。其中大多数PTP是Cys-based,可进一步分为3个class。Class 1包括经典的磷酸化酪氨酸特异性受体PTPs(RPTPs)、非受体PTPs (NRPTPs)和双特异性PTPs (dual-specificity PTPs, DSPs)。DSP可以去磷酸化Tyr和Ser/Thr残基以及脂质,并细分为经典MAP激酶磷酸酶(MAP kinase phosphatases, MKP)或非典型DSP (atypical DSPs)。Class 2与某些细菌砷酸盐还原酶具有同源性,包含低分子量PTP和SSu72。Class 3包含三个CDC25 PTP,这些PTP包含一个硫氰酸酶磷酸酶结构域。His-based PTP由两个UBASH3磷酸酶组成,它们是组氨酸磷酸酶(HP)的一部分并使用His作为亲核试剂。
HAD超家族磷酸酶使用Asp残基作为催化亲核试剂,使用Mg2+作为辅因子,并含有DxDx(V/T)活性位点特征基序,包含EYA磷酸酶和FCP和SCP等。
三、磷酸酶靶点与抑制剂
在过去的研究中一直认为磷酸酶是难成药靶点,然而最近磷酸酶在临床前被口服生物利用疗法选择性靶向,并且由于新的生物学见解而出现了新的磷酸酶靶点,因此科学家对这些酶的兴趣又有了重大的复苏。此外,磷酸酶活性位点的竞争性靶向并没有被完全放弃,特别是在可以获得高效药物或活性位点含有结构独特特征的情况下。虽然最近大多数靶向磷酸酶的化合物是变构抑制剂,但其他新的形式也越来越普遍(图2)。在过去的几年中,免疫细胞中的几种蛋白磷酸酶已成为自身免疫和肿瘤免疫治疗适应症的候选治疗靶点。最有效的靶点是PTPN2 (TCPTP)和SHP2,目前临床试验中的小分子抑制剂用于肿瘤免疫治疗适应症。
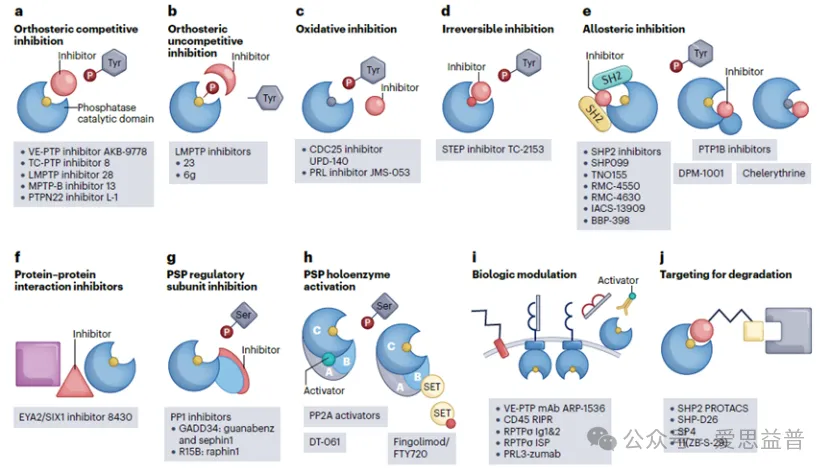
图2 磷酸酶靶向药物作用机理
四、PTPN2/TC-PTP生物学活性和抑制剂开发现状
PTPN2基因编码PTPN2蛋白,也称为TC-PCP(T cell protein tyrosine phosphatase),最初是从人类T细胞cDNA文库中克隆而来的。作为一种信号分子,PTPN2通过去磷酸化受体蛋白酪氨酸激酶来调节多种细胞过程,例如EGFR,CSF1R,PDGFR,IR;或非受体蛋白酪氨酸激酶,例如JAK、Src或STAT家族激酶。human PTPN2由于可变剪接存在两种功能型同源异构体,分别为45 kD and 48 kD。45 kD PTPN2由于DBD结构域的二双分核定位信号定位于细胞核,在胰岛素、表皮生长因子、肿瘤坏死因子和干扰素-γ等细胞刺激下穿梭到细胞质中,从而在细胞质和质膜处进行底物去磷酸化。48 kD PTPN2由于C末端疏水结构掩盖了核定位序列,定位在细胞的内质网上。
TC-PTP在自身免疫性疾病、癌症和癌症免疫监视中发挥作用,是免疫介导疾病极具吸引力的靶标。TC-PTP是一种免疫变阻器,其调节作用使免疫系统倾向于抑制自身免疫和炎症或激活抗肿瘤反应。多种证据表明激活TC-PTP是治疗自身免疫疾病的候选靶点;但抑制肿瘤细胞中的TC-PTP使肿瘤更容易受到免疫细胞浸润和细胞毒性T细胞的攻击[10]。在移植的小鼠B16黑色素瘤肿瘤中使用CRISPR-Cas9基因组编辑进行的体内遗传筛选中发现TC-PTP缺失增加了肿瘤对包含抗PD1抗体和肿瘤细胞疫苗(GVAX)的免疫疗法的敏感性[11]。TC-PTP也被认为是使肿瘤细胞对CD8+T细胞或IFN-γ致敏的靶标[12]。在抗PDL1耐药的YUMM1.1小鼠黑色素瘤模型中,TC-PTP稳定敲低可抑制肿瘤生长并使肿瘤对抗PDL1抗体的抑制敏感,这种敏感性取决于T细胞的存在[13]。进一步的研究表明TC-PTP缺失增强小鼠抗肿瘤免疫并且增强CAT-T细胞功能[14,15]。
为了支持TC-PTP作为免疫治疗靶点,Calico和艾伯维开发的两种口服生物可用的TC-PTP抑制剂ABBV-CLS-579和ABBVCLS-484(专利号WO/2019/246513)目前正在进行局部晚期或转移性肿瘤的I期临床试验。
五、SHP2生物学活性和抑制剂开发现状
SHP2由PTPN11基因编码,体内普遍表达。与其同系物SHP1一样,由串联SH2结构域(N-SH2和C-SH2)、PTP结构域和无序的包含酪氨酸磷酸化位点的C端尾部组成。SHP2受分子内自抑制构象调控,其中N-SH2残基插入PTP结构域催化裂口 (图3) [18,19]。SHP2 的SH2结构域与相互作用蛋白的磷酸酪氨酸残基结合,使酶转变为开放的活性构象[20]。此外,尾部Tyr的磷酸化为相互作用蛋白或其C-SH2提供了对接位点,这也增强了SHP2的激活。SHP2也可以存在于部分开放状态,其中N -SH2允许访问活性位点。
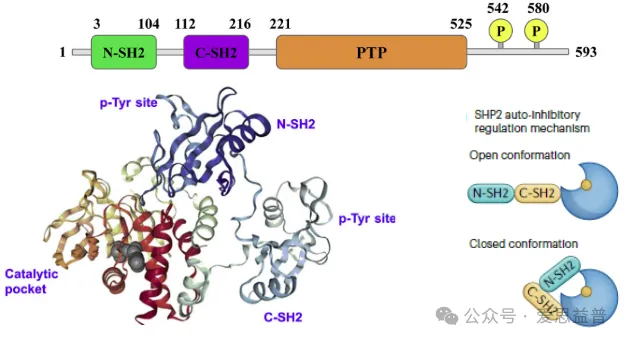
图3. SHP2的结构
到目前为止,少量研究表明SHP2在自身免疫中的作用以及SHP2作为自身免疫靶点的潜力。编码SHP2的PTPN11位于与RA相关的连锁不平衡区内[21]。髓样细胞中诱导的杂合SHP2缺失可减少小鼠的炎症性关节炎,表明SHP2在骨髓细胞中具有促进关节炎的作用[22]。此外,用双配位基的SHP2抑制剂11a-1治疗可减轻小鼠的炎症性关节炎。此外,来自系统性红斑狼疮(SLE)易感MRL-lpr小鼠的外周血单核细胞和脾中的SHP2活性增加,并且11a-1治疗可减少这些小鼠的疾病[23]。这些发现表明有必要进一步探索SHP2在RA、SLE和潜在的其他自身免疫性疾病中的作用。
SHP2促进受体酪氨酸激酶(RTK)下游的RAS-RAF-MAPK信号传导,SHP2位于多条受体酪氨酸激酶(RTK)信号通路上的节点位置,几乎所有的RTK均通过激活SHP2来启动RAS信号通路,而激活RAS对癌细胞的生长和存活都非常重要。因此,一个合适的SHP2抑制剂可以应对不同型的RTK基因突变,具有成为广谱抗癌药物的潜力。由于SHP2与蛋白酪氨酸激酶(PTK)信号通路的重叠,SHP2抑制剂可以与激酶抑制剂联用从而对相互连接的信号通路进行双重抑制,这种组合疗法比单一疗法更有效,既不易产生耐药性,又能逆转PTK抑制剂的获得性耐药性。此外,SHP2还参与程序细胞死亡检查点PD-1/PD-L1的信号通路,调节T细胞的活性。SHP2介导的对多种信号通路的抑制共同阻止T细胞活化。T细胞中的许多免疫抑制受体,如PD-1、CLTA-4、BTLA、TIGIT等,可以通过其细胞质区域的各种基序招募SHP2(图4)[24]。鉴于当前抗PD-1/PD-L1肿瘤免疫疗法在临床上的成功应用,SHP2小分子抑制剂作为PD-1/PD-L1药物的重要补充,在肿瘤免疫治疗方面备受临床期待。因此,SHP2被认为是一个理想的癌症干预靶标,其抑制剂的开发已成为当前抗癌新药研究的热点。
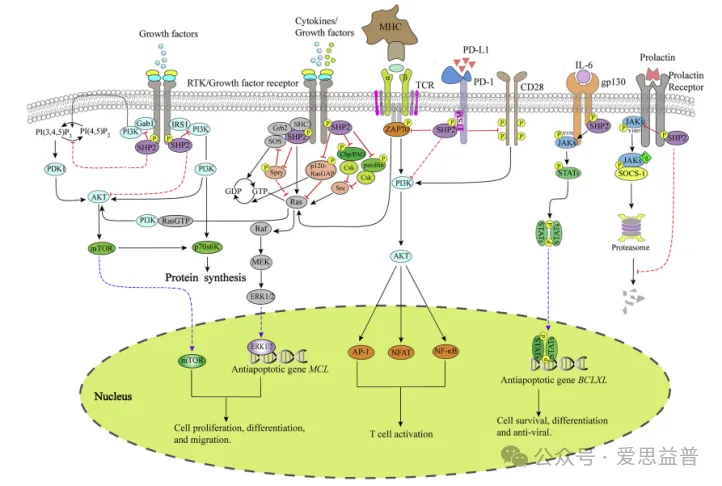
图4. SHP2在癌细胞中的调节通路
目前已经开发了几种口服变构SHP2抑制剂,其中一些正在进行癌症临床试验。这些化合物就像“分子胶”一样,通过结合由酶的封闭构象产生的口袋来稳定SHP2的自抑制状态[25,26],并且比其他磷酸酶和激酶具有高度选择性。诺华(Novartis)报道的化合物SHP099能结合到2个SH2结构域和PTP结构域三者之间,并将酶锁定在其封闭的非活性构象中而抑制SHP2活性,这一独特的作用方式使SHP099成为首个高选择性的SHP2抑制剂,其发现为SHP2这一靶点的研究开启了希望之门。TNO155由于缺乏SHP099的hERG2结合和光毒性问题成为全球首款进入临床阶段的SHP2别构抑制剂,正在I期和I/II期临床试验中进行测试。
SHP2抑制剂与多个信号通路成员的抑制剂或抗体的联合用药(联合RTKs、Raf、MEK、ERK和PD-1抗体等)可潜在增强抗肿瘤应答、增加抗肿瘤免疫,表现出协同抗肿瘤作用。SHP099或TNO155与抗PD1联合使用,倾向于增强CD8+ T细胞的活化和肿瘤浸润。SHP2抑制也正在与KRAS-G12C抑制剂联合使用,以增强对携带KRASG12C突变的肿瘤的免疫力。
其他进入临床的药物还有Revolution Medicines和赛诺菲联合研发的RMC-4630、Erasca公司的ERAS-601、Relay Therapeutics公司的RLY-1971和辉瑞公司的PF-07284892等;国内企业包括:加思科JAB-3068和JAB-3312,联拓生物的BBP-398、奕拓医药的ET0038、圣和药业的SH3809、上海歌斐木生物的BR790、诺诚健华的ICP-189、江苏豪森药业的HS-10381及贝达药业的BPI-442096等。随着药物开发策略的不断开拓发展,靶向SHP2为抗肿瘤治疗提供了广阔的应用前景,也使得靶向SHP2抗肿瘤药物的开发成为热点之一。
六、其他磷酸酶抑制剂的开发现状
SHP1是一种由PTPN6编码的非受体PTP,在造血细胞中表达,并且在上皮细胞中表达几种同种异构体。造血细胞SHP1主要存在于细胞质中,而上皮细胞SHP1则定位于细胞核,这表明这些形式的SHP1可能作用于不同的底物。SHP1的结构与自身抑制调控与SHP2相似,其中N-SH2阻断底物进入活性位点。目前的研究表明SHP1缺失增强小鼠抗肿瘤免疫,且SHP1抑制剂增强小鼠抗肿瘤免疫[27,28]。
PTP1B是一种非跨膜蛋白酪氨酸磷酸酶,位于胞浆内质网,与蛋白络氨酸激酶PTK共同维持着络氨酸蛋白磷酸化的平衡。随后的研究表明PTP1B是胰岛素信号转导通路中关键的负调节蛋白,被确定为治疗II型糖尿病和肥胖的潜在靶点,但在30多年的药物开发中发现细胞膜通透性差和选择性不佳是阻碍PTP1B小分子抑制剂开发进程的主要原因,使得很多项目终止。目前Ionis Pharmaceuticals公司开发的靶向PTP1B的反义寡核苷酸治疗2型糖尿病药物进入临床二期。DepYmed研发的在研适应症为乳腺癌PTP1B抑制剂Trodusquemine处于临床一期。
PP2A是一种普遍表达的异三聚体酶, PP2A调节多种细胞过程,包括生长、细胞周期、有丝分裂、分化和凋亡。目前的研究表明抑制PP2A能够抑制自身免疫疾病。PP2A也正在成为增强T细胞抗肿瘤反应的靶点。PP2A/PP5抑制剂LB-100(也称为LB-1)是去甲斑蝥素的衍生物,是一种天然化合物斑蝥素的去甲基化类似物,现被确定为肿瘤放射和化学增敏剂,并完成了与多西他赛(NCT01837667)联合治疗实体肿瘤的I期临床试验。该化合物还正在进行复发性胶质母细胞瘤的II期临床试验(NCT03027388),骨髓增生异常综合征的I/II期临床试验(NCT03886662)以及与三种标准化疗药物联合治疗广泛期小细胞肺癌的Ib期临床试验(NCT04560972)。
PTPN22是一种在造血细胞中表达的非受体PTP。PTPN22包含一个N端PTP结构域,一个中间结构域和一个CTD结构域,其中CTD结构域包括四个脯氨酸丰富的序列基序,其中第一个与Src家族激酶(CSK)的C端SH3结构域结合。PTPN22通过去磷酸化SFKs、ZAP70、TCRζ、Vav和valosin-containing protein1等早期信号介质来抑制TCR信号传导。目前有广泛的遗传证据表明PTPN22与自身免疫疾病发病机制有关,抑制或缺失PTPN22能够抑制自身免疫疾病和抑制肿瘤生长[29]。
七、爱思益普磷酸酶筛选平台介绍
爱思益普生物化学部(IBC)打造了集蛋白纯化、酶学方法开发、抑制剂活性筛选于一体的磷酸酶筛选平台,为磷酸酶抑制剂筛选及选择性测试提供完善的服务。
爱思益普目前已经纯化出磷酸酶多个蛋白,蛋白团队拥有多年丰富的工作经验,每批蛋白都会经过活性验证,以保证纯度和活性,充分满足各种实验需求。
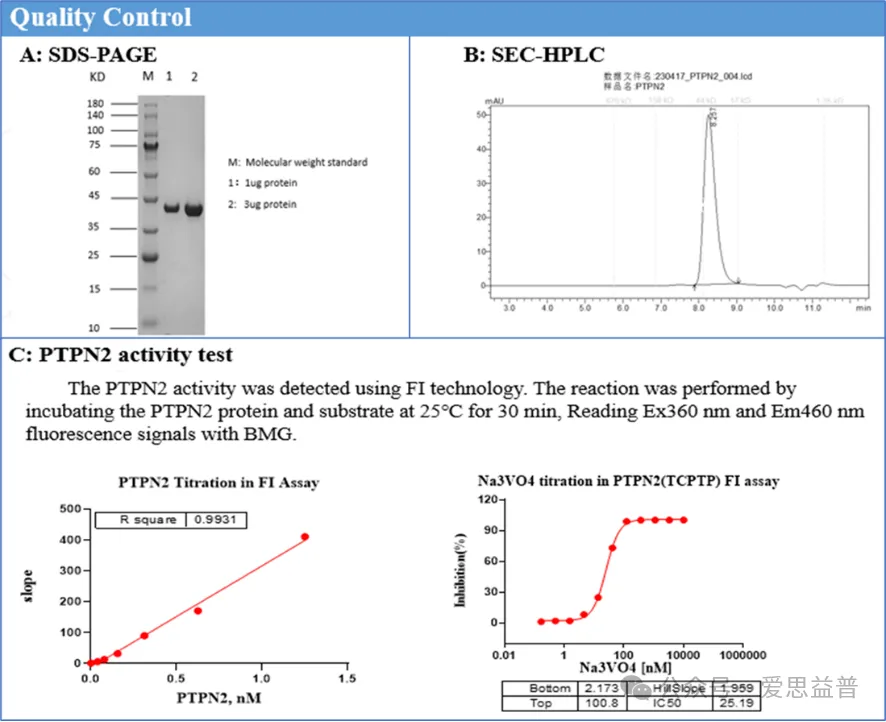
2、检测小分子对磷酸酶酶活性的抑制作用
爱思益普通过FI(荧光强度)的方法检测小分子对磷酸酶的活性抑制。ICE平台目前已经完成磷酸酶系列众多靶点的检测实验,例如PP1A,SHP2,SHP1等如下汇总。
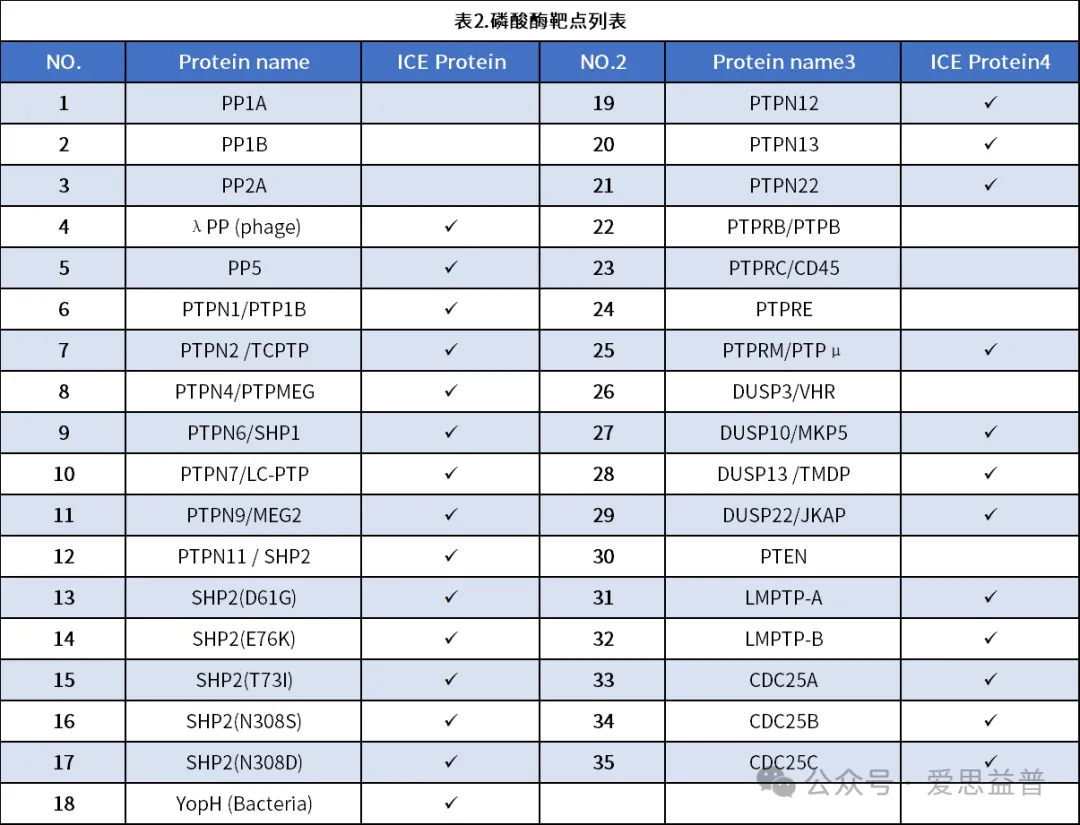
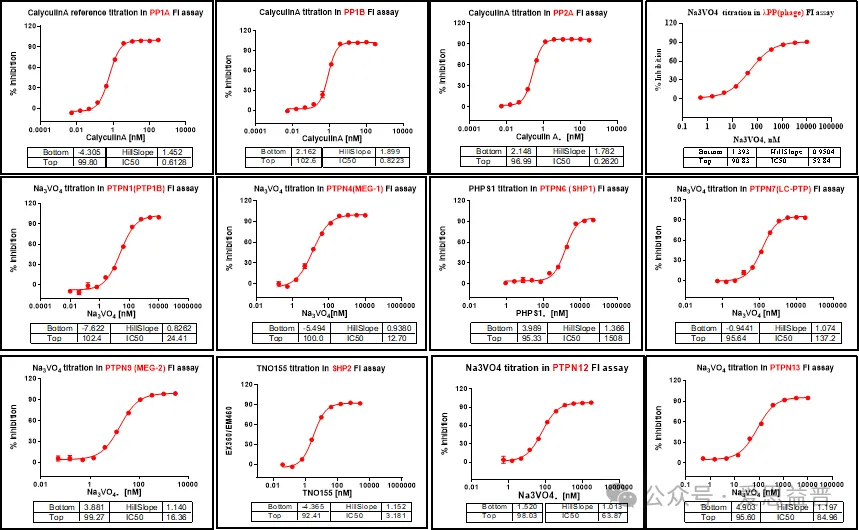
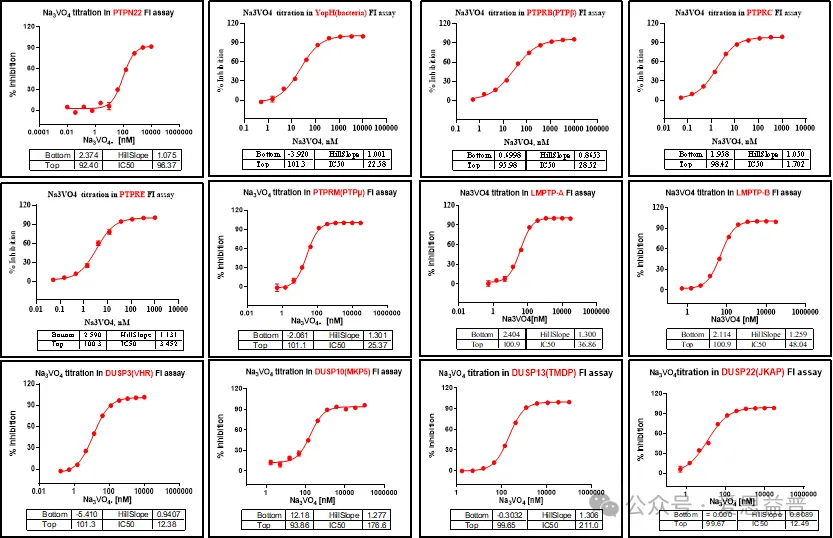
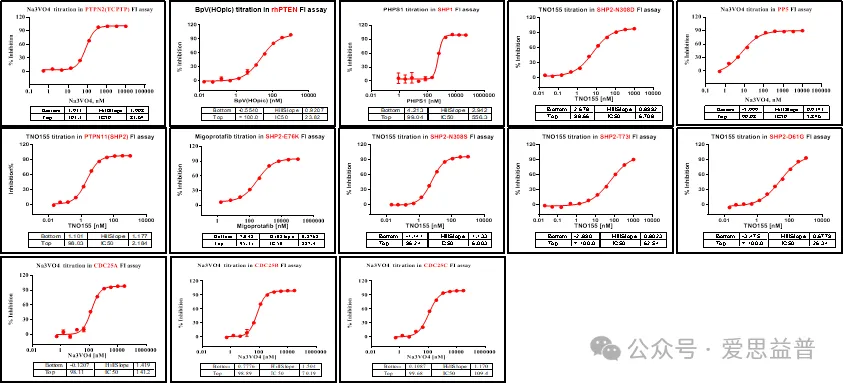
ICE-Phophatase Panel curves汇总
八、小结
在磷酸酶调节剂的开发中,一系列具有影响力的事件激发了磷酸酶药物的爆炸式发展,其中包括变构磷酸酶调节剂的发现,具有独特作用机制的其他磷酸酶调节剂的发现以及磷酸酶抑制剂进入临床试验的进展。这些进展加上对磷酸酶生物学功能的深入了解表明,曾经被认为不可成药的酶实际上可能是各种人类疾病的关键靶点。
爱思益普除了具备完整的磷酸酶生物化学平台,同时在细胞生物学,DMPK分析,体内动物模型的药效评价以及神经心脏安全和体外次级药理学安全性评价(Safety panel)等方面拥有丰富的服务经验。对磷酸酶相关服务感兴趣的同仁,可以随时联系我们索取资料!
参考文献
[1] Hunter, T. The genesis of tyrosine phosphorylation. Cold Spring Harb. Perspect. Biol. 6,
a020644 (2014).
[2] Tonks, N. K. Protein tyrosine phosphatases–from housekeeping enzymes to master regulators of signal transduction. FEBS J. 280, 346–378 (2013).
[3] Roskoski, R. Jr. A historical overview of protein kinases and their targeted small molecule inhibitors. Pharmacol. Res. 100, 1–23 (2015).
[4] Chen, M. J., Dixon, J. E. & Manning, G. Genomics and evolution of protein phosphatases. Sci. Signal. 10, eaag1796 (2017).
[5] Alonso, A. & Pulido, R. The extended human PTPome: a growing tyrosine phosphatase
family. FEBS J. 283, 1404–1429 (2016).
[6] Brautigan, D. L. & Shenolikar, S. Protein serine/threonine phosphatases: keys to unlocking regulators and substrates. Annu. Rev. Biochem. 87, 921–964 (2018).
[7] Fowle, H., Zhao, Z. & Grana, X. PP2A holoenzymes, substrate specificity driving cellular functions and deregulation in cancer. Adv. Cancer Res. 144, 55–93 (2019).
[8] Shi, Y. Serine/threonine phosphatases: mechanism through structure. Cell 139, 468–484 (2009).
[9] Roychoudhury, K. & Hegde, R. S. The eyes absent proteins: unusual HAD family tyrosine phosphatases. Int. J. Mol. Sci. 22, 3925 (2021).
[10] LaFleur, M. W. et al. PTPN2 regulates the generation of exhausted CD8+ T cell subpopulations and restrains tumor immunity. Nat. Immunol. 20, 1335–1347 (2019).
[11] Manguso, R. T. et al. In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target. Nature 547, 413–418 (2017).
[12] Lawson, K. A. et al. Functional genomic landscape of cancer-intrinsic evasion of killing by T cells. Nature 586, 120–126 (2020).
[13] Luo, N. et al. Melanoma response to anti-PD-L1 immunotherapy requires JAK1 signaling, but not JAK2. Oncoimmunology 7, e1438106 (2018).
[14] Katkeviciute, E. et al. Protein tyrosine phosphatase nonreceptor type 2 controls colorectal cancer development. J. Clin. Investig. 131, e140281 (2021).
[15] Wiede, F. et al. PTPN2 phosphatase deletion in T cells promotes anti-tumour immunity and CAR T-cell efficacy in solid tumours. EMBO J. 39, e103637 (2020).
[16] Wiede, F. et al. PTP1B is an intracellular checkpoint that limits T cell and CAR T cell anti-tumor immunity. Cancer Discov. 12, 752–773 (2022).
[17] Penafuerte, C. et al. Downregulation of PTP1B and TC-PTP phosphatases potentiate dendritic cell-based immunotherapy through IL-12/IFNγ signaling. Oncoimmunology 6, e1321185 (2017).
[18] Hof, P., Pluskey, S., Dhe-Paganon, S., Eck, M. J. & Shoelson, S. E. Crystal structure of the tyrosine phosphatase SHP-2. Cell 92, 441–450 (1998).
[19] Barford, D. & Neel, B. G. Revealing mechanisms for SH2 domain mediated regulation of the protein tyrosine phosphatase SHP-2. Structure 6, 249–254 (1998).
[20] Poole, A. W. & Jones, M. L. A SHPing tale: perspectives on the regulation of SHP-1 and SHP-2 tyrosine phosphatases by the C-terminal tail. Cell Signal. 17, 1323–1332 (2005).
[21] Zhernakova, A. et al. Meta-analysis of genome-wide association studies in celiac disease and rheumatoid arthritis identifies fourteen non-HLA shared loci. PLoS Genet. 7, e1002004 (2011).
[22] Maeshima, K. et al. Abnormal PTPN11 enhancer methylation promotes rheumatoid arthritis fibroblast-like synoviocyte aggressiveness and joint inflammation. JCI Insight 1, e86580 (2016).
[23] Wang, J. et al. Inhibition of SHP2 ameliorates the pathogenesis of systemic lupus erythematosus. J. Clin. Invest. 126, 2077–2092 (2016).
[24] Song Y, Zhao M, Zhang H, Yu B. Double-edged roles of protein tyrosine phosphatase SHP2 in cancer and its inhibitors in clinical trials. Pharmacol Ther. 2022 Feb;230:107966.
[25] Chen, Y. N. et al. Allosteric inhibition of SHP2 phosphatase inhibits cancers driven by receptor tyrosine kinases. Nature 535, 148–152 (2016).
[26] Garcia Fortanet, J. et al. Allosteric Inhibition of SHP2: identification of a potent, selective, and orally efficacious phosphatase inhibitor. J. Med. Chem. 59, 7773–7782 (2016).
[27] Hoffmann, M. M. & Slansky, J. E. T-cell receptor affinity in the age of cancer immunotherapy. Mol. Carcinog. 59, 862–870 (2020).
[28] Kundu, S. et al. Novel SHP-1 inhibitors tyrosine phosphatase inhibitor-1 and analogs with preclinical anti-tumor activities as tolerated oral agents. J. Immunol. 184, 6529–6536 (2010).
[29] Ho, W. J. et al. Systemic inhibition of PTPN22 augments anticancer immunity. J. Clin.Invest. 131, e146950 (2021).
