News Detail
 来源:本站
来源:本站
 浏览量:15139
浏览量:15139
背景介绍
在细胞的生命周期中,细胞会受到不同类型的辐射或基因毒剂等外源性以及碱基脱嘌呤和脱氨基作用等内源性损伤。为了在这些不利条件下生存并将完整的遗传信息传递给后代,细胞已经形成了一个复杂的信号通路网络—统称为DNA损伤反应(DDR),这种反应是生物体感知DNA损伤信号、减缓或阻滞细胞周期进程(细胞周期检查点)、激活不同的DNA修复机制或细胞凋亡机制的基础。DDR是一个由蛋白质磷酸化驱动的信号转导通路,主要包括碱基切除修复 (BER)、同源重组修复(HR)、非同源末端连接(NHEJ)、核苷酸切除修复(NER)和错配修复 (MMR)。
图1:DNA损伤反应示意图
碱基切除修复 (BER):主要修复氧化、烷基化、脱氨基作用及电离辐射等最普遍的DNA损伤。BER主要负责修复小损伤,当碱基损伤时,脱嘌呤/脱嘧啶核酸内切酶(APE)切割AP位点,在损伤部位形成3’羟基末端,DNA聚合酶和DNA连接酶在去除损伤碱基时产生的缺口处被募集,从而封闭缺口。
核苷酸切除修复(NER):主要修复紫外辐射和化学诱变剂导致的大量双螺旋扭曲损伤。NER涉及一种关键蛋白质,即切除修复交叉互补蛋白1(ERCC1),它会清除断裂点附近的DNA,然后用正常的DNA复制进行替换。
同源重组修复(HR):修复DNA双链断裂(DSB)的主要途径,DNA双链断裂(DSB)是最为严重和最具威胁性的一种损伤类型,而HR能准确修复最严重和最复杂的DNA损伤,主要作用于 S/G2 细胞周期阶段。HR首先切除断裂端,随后通过Brca2和Rad51形成Rad51核蛋白丝,开始检索同源序列,并促进断裂DNA和同源模板之间形成连接分子,完成修复。HR介导的DSB反应的核心成分是属于PI3K相关激酶(PIKK)家族的ATM(毛细血管扩张性共济失调症突变激酶)和ATR(ATM和Rad3相关激酶)。PIKK家族成员还包括mTOR、TRAAP、SMG-1和DNA -PKcs。
非同源末端连接(NHEJ):DNA双链断裂(DSB)修复的最简单机制,也是修复DSBs 的另一条主要途径,作用于除 M 期以外的所有细胞周期阶段。NHEJ可忽略序列的同源性,直接连接断裂的DNA两端,因而无法精准修复。PIKK家族的DNA -PKcs主要在非同源末端(NHEJ)发挥作用,ATM也参与NHEJ。
错配修复 (MMR):是针对复制相关错误的DNA修复途径,主要用于纠正DNA合成过程中核苷酸的错误整合,从而防止分裂细胞中DNA的永久性损伤。
ATM和ATR结构及功能
ATM和ATR都是磷脂酰肌醇3-激酶(PI3K)相关激酶(PIKK)蛋白家族的成员。其中ATM由3056个氨基酸组成,ATR由2644个氨基酸组成。在人体细胞中,绝大多数ATR是以ATR-ATRIP复合物(如图2)的形式存在。ATR-ATRIP 复合物呈现为空心“心型”,由ATRIP连接两个不同构象的 ATR 单体组成。ATM二聚体为一种蝴蝶结构,两个单体呈双重对称。ATM和ATR结构类似,都包含一个大的 N 端 α 螺线管(包含 N 端和 中间 HEAT 重复区域,分别被称为N-HEAT 和 M-HEAT)、FAT(FRAP,ATM,TRRAP) 结构域、激酶结构域 (KD) 和 C 端 (FATC)结构域。N端超螺旋HEAT重复区域主要调节蛋白质之间的相互作用, 其中ATR的N端超螺旋HEAT重复区域是ATRIP的结合区域,也是ATR激酶被激活的重要区域。C端负责磷酸化氨基酸并改变其活性,特别是对丝氨酸或苏氨酸残基(Ser/Thr)的磷酸化。FAT 和 FATC 域与激酶活性的调节有关,但其功能尚未被完全理解。
图2:ATR-ATRIP复合物和ATM二聚体结构示意图
ATM 和 ATR 对 DNA 损伤的特异性和功能性有所不同,ATM主要参与DSB(DNA双链断裂)修复。在未受损的细胞中,ATM以二聚体或低聚体的形式存在,DNA双链断裂后,MRE11-RAD50-NBS1 (MRN)复合物激活ATM,并在丝氨酸367(ser367)、丝氨酸1893(ser1893)、丝氨酸1981(ser1981)和丝氨酸2996(ser2996)处自动磷酸化。从而诱发被MRE11-RAD50-NBS1 (MRN)复合体招募到DSB位点的p53(肿瘤抑制因子)、CHK1和CHK2等发生一系列复杂的磷酸化级联反应,并通过抑制CDK2的活性来阻滞G1/S或G2/M细胞周期进程,从而使细胞在进入有丝分裂前有更多的时间进行DNA损伤修复。或者,如果损伤太广泛,便激活相应的衰老或凋亡途径。
ATR主要参与SSB(DNA单链断裂)修复。当细胞内有DNA复制压力或DNA损伤产生时,复制相关蛋白A(RPA)包裹单链DNA(ssDNA)并形成RPA-ssDNA复合物,并招募ATR激活所需的调控因子:ATRIP、9-1-1复合物(Rad9-Rad1-Hus1)和拓扑异构酶II结合蛋白1 (TopBP1)等。ATR与其配体ATRIP结合并被招募到RPA-ssDNA上形成ATR-ATRIP复合物,同时ATR在位点T1989发生自磷酸化。ATR一旦被激活,便会通过磷酸化CHK1和CHK2.导致CDC25发生磷酸化并失活,从而不能激活CDK2.同时这些病变还直接或通过CHK1激活WEE1.使CDK1和CDK2磷酸化并失活,从而阻滞G1/S或G2/M细胞周期进程。
图3:ATR和ATM通路示意图
然而,ATM和ATR在一定程度上也会相互影响。第一,ATM和ATR可以影响彼此在DNA损伤部位的募集。如在DSB中,ATM可以通过增强DNA末端切除来促进ATR的激活。ATR也被证明在DNA复制应激下磷酸化H2AX,这可能会将ATM招募到与应激复制叉相邻的染色质中。第二,ATM和ATR可以直接相互磷酸化。研究表明,ATM在Ser1981可以被ATR磷酸化,以应对DNA复制应激。第三,ATM和ATR可能会影响彼此通路中损伤反应蛋白的功能和募集。如ATM可以磷酸化TopBP1并促进其与 ATR 的相互作用。第四,ATM和ATR 在DDR通路中存在功能冗余。即使没有ATM,缓慢切除DNA末端仍可以激活ATR。同样,当ATR通路失活时,DNA复制压力也会激活ATM。
人类ATM基因的突变会导致共济失调毛细血管扩张症的发生,其特点是小脑退化、免疫缺陷和癌症风险增加。ATR 双等位基因的丧失会导致早期胚胎致死。研究发现, ATM和ATR 激酶在这些癌细胞中被激活或上调,同时ATR是ATM突变的合成致死靶点,ATM缺失的肿瘤细胞对于ATR抑制剂更加敏感。ATM和ATR的选择性抑制为肿瘤治疗提供了新的思路,也为肿瘤研究提供了新的工具。
ATM和ATR抑制剂的开发现状
近年来,通过靶向ATM和ATR激酶来研究抗肿瘤药物受到了学术界和制药公司的青睐,已有多种小分子抑制剂作用于ATM和ATR,并已作为单药或与放疗/化疗联合进行Ⅰ期或Ⅱ期临床试验。目前已有8种ATR抑制剂进入临床试验:Berzosertib、M4344 、Ceralasertib、M1774 、ATRN-119 、RP-3500 、ART-0380 、Elimusertib(图4)。其中Berzosertib是一个进入临床试验的ATR抑制剂,是具有高选择性的VE-821的衍生物。今年三月,英派药业也宣布,其自主研发的ATR抑制剂IMP9064获得中国国家药监局(NMPA)的批准,将在中国启动临床试验。
图4:ATR抑制剂研究在研情况
当前进入临床阶段的ATM抑制剂有3个,分别为AZD-1390、M-4076、XRD-0394(图5)。
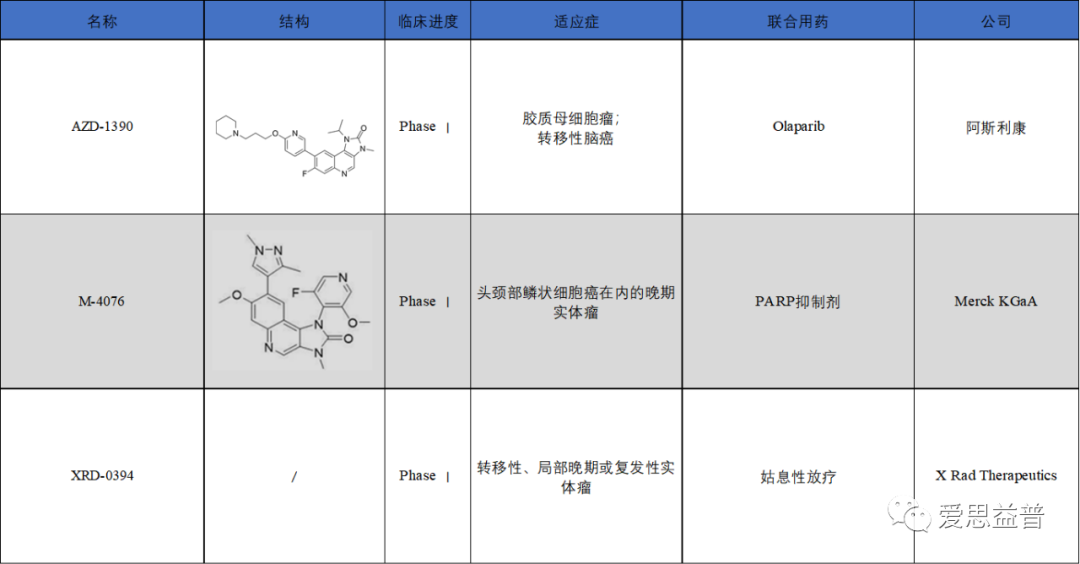
图5:ATM抑制剂研究在研情况
结束语
爱思益普专注于基于靶点的先导化合物筛选和优化,批量构建了新药筛选的靶点和筛选技术,致力于以高效、专业的服务,帮助新药研发企业快速有效地推进新药研发项目。在PIKK激酶家族中,我们构建了HTRF方法用于筛选ATM和ATR抑制剂。
在ATM或ATR的催化作用下,p53被磷酸化,当供体(Eu)和受体(d2)分别与磷酸化的 p53 相互作用时,彼此之间会有足够近的距离并发生能量转移。从而可以通过信号强弱来判断ATM或ATR蛋白活性高低。实验原理见图6.
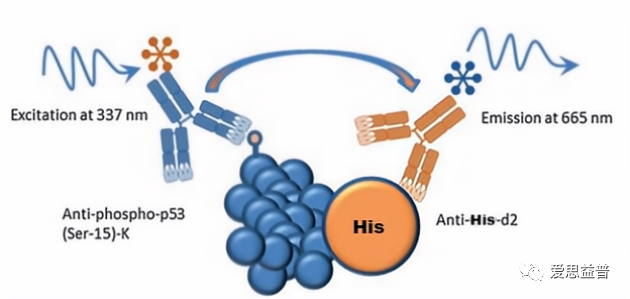
图6:实验原理示意图
我们的测定结果显示,ATM阳性药KU-55933的IC50稳定在3.6 nM;ATR阳性药AZD6738的IC50稳定在1 nM;上述实验结果均稳定可重复,适用于快速、通量的小分子抑制剂筛选。
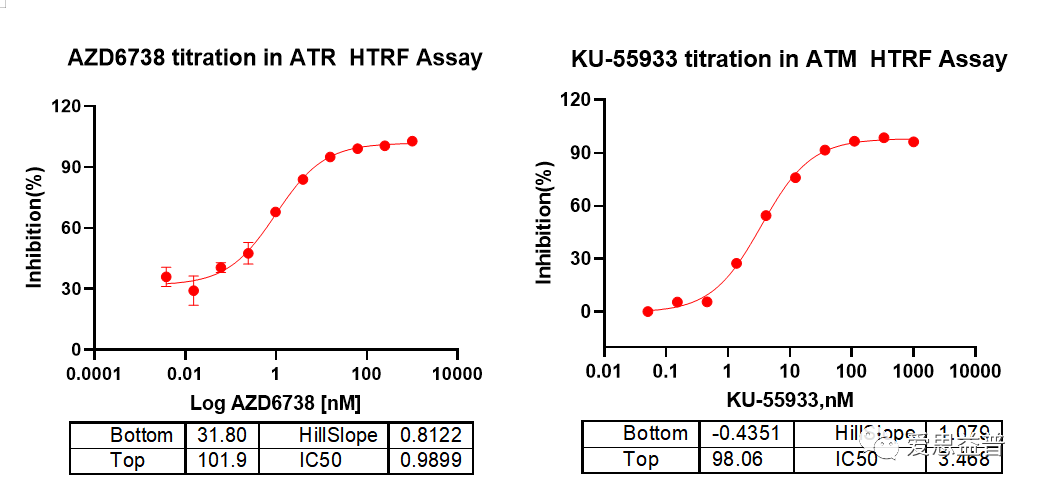
数据来源于爱思益普
ICE在DNA损伤领域积极布局,目前已经积累大部分DDR相关靶点的评价方法(如下表),同时也在积极拓展合成致死新靶点的方法优化和构建,欢迎垂询、沟通细节。
参考文献
1. MenendezDaniel, Anand Jay R, Murphy Carri C, Bell Whitney J, Fu Jiaqi,Slepushkina adia, Buehler Eugen, Martin Scott E, LalNag Madhu, NitissJohn L, Resnick Michael A. Etoposide-induced DNA damage is increased inp53 mutants: identification of ATR and other genes that influenceeffects of p53 mutations on Top2-induced cytotoxicity. [J]. Oncotarget,2022, 13.
2. WangManni, Chen Siyuan, Ao Danyi. Targeting DNA repair pathway in cancer: Mechanisms and clinical application[J]. MedComm, 2021, 2(4).
3. MinlinJiang, Keyi Jia, Lei Wang, Wei Li, Bin Chen, Yu Liu, Hao Wang, ShaZhao, Yayi He, Caicun Zhou. Alterations of DNA damage response pathway:Biomarker and therapeuticstrategy for cancer immunotherapy[J]. ActaPharmaceutica Sinica B, 2021, 11(10): 2983-2994.
4. HannahL. Smith, Harriet Southgate, Deborah A. Tweddle, Nicola J. Curtin. DNAdamage checkpoint kinases in cancer[J]. Expert Reviews in MolecularMedicine, 2020, 22.
5. ZhaojunQiu, Nancy L. Oleinick, Junran Zhang. ATR/CHK1 inhibitors and cancertherapy[J]. Radiotherapy and Oncology, 2018, 126(3).
6. AndreN. Blackford,Stephen P. Jackson. ATM, ATR, and DNA-PK: The Trinity atthe Heart of the DNA Damage Response[J]. Molecular Cell, 2017, 66(6).
7. RaghavSundar, Jessica Brown, Alvaro Ingles Russo, Timothy A. Yap. TargetingATR in cancer medicine[J]. Current Problems in Cancer, 2017, 41(4).
8. AnikaMaria Weber, Anderson Joseph Ryan. ATM and ATR as therapeutic targetsin cancer[J]. Pharmacology & Therapeutics, 2015, 149.
9. MaréchalAlexandre, Zou Lee. DNA damage sensing by the ATM and ATR kinases[J].Cold Spring Harbor perspectives in biology, 2013, 5(9).
10. JoanneSmith, Lye Mun Tho, Naihan Xu, David A. Gillespie. The ATM–Chk2 andATR–Chk1 Pathways in DNA Damage Signaling and Cancer[J]. Advances inCancer Research, 2010, 108(SUPP C).
11. WangLW, Jiang S, Yuan YH, Duan J, Mao ND, Hui Z, Bai R, Xie T, Ye XY.Recent Advances in Synergistic Antitumor Effects Exploited from theInhibition of Ataxia Telangiectasia and RAD3-Related Protein Kinase(ATR)[J]. Molecules. 2022 Apr 12; 27(8): 2491.
12. AdamsP, Clark J, Hawdon S, Hill J, Plater A. An HTRF® Assay for theProtein Kinase ATM[J]. Methods Mol Biol. 2017; 1599: 43-56.
13. XiaoJianxiong, Liu Mengjie, Qi Yilun, Chaban Yuriy, Gao Chao, Pan Beiqing,Tian Yuan, Yu Zishuo, Li Jie, Zhang Peijun, Xu Yanhui. Structuralinsights into the activation of ATM kinase[J]. Cell research, 2019,29(8).
14. OmarL. Kantidze,Artem K. Velichko,Artem V. Luzhin, Nadezhda V. Petrova,Sergey V. Razin. Synthetically Lethal Interactions of ATM, ATR, andDNA-PKcs[J]. Trends in Cancer, 2018, 4(11).
15. RaoQinhui, Liu Mengjie, Tian Yuan, Wu Zihan, Hao Yuhan, Song Lei, QinZhaoyu, Ding Chen, Wang Hong-Wei, Wang Jiawei, Xu Yanhui. Cryo-EMstructure of human ATR-ATRIP complex[J]. Cell research, 2018, 28(2).
地址:北京市通州区科创十三街与经海路交汇处
电话:010-67809840
邮箱:services@ice-biosci.com
官网:http://www.ice-biosci.com/