News Detail
 来源:本站
来源:本站
 浏览量:11590
浏览量:11590
由新型冠状病毒SARS-CoV-2引发的疫情自2019年底爆发以来在全球快速传播,截至2022年9月,全世界感染人数已超过6亿人,死亡人数超过600万(WHO COVID-19 Dashboard)。新型冠状病毒疫情(COVID-19)引起了人们对公共卫生的高度关注,也在生物医药领域掀起了对疫苗、抗体及小分子化合物药物研发的热潮。SARS-CoV-2通常会先黏附于呼吸道表面粘膜的硫酸乙酰肝素,进而与hACE2结合,之后入侵机体触发炎症因子风暴,并在肺部导致弥漫性肺泡损伤和纤维化,最终引起肺水肿和呼吸衰竭[1],如图1所示。
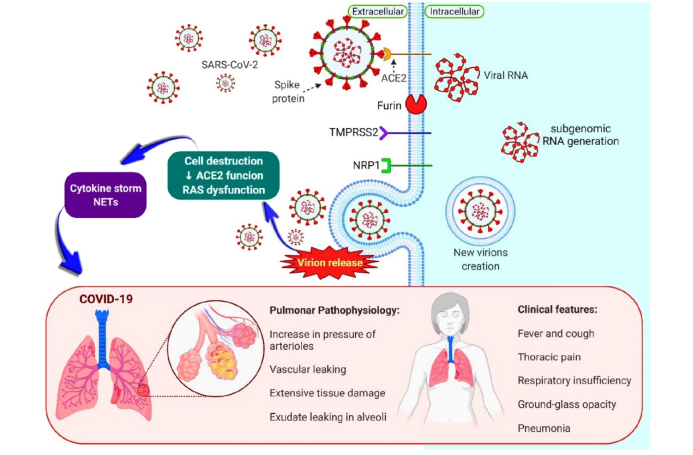
图1 SARS-CoV-2的感染及肺部病变[1]
在新药研发的过程中,动物模型是目前评价药物在体内安全性和有效性的最常规手段,但动物模型与人体实际状态差异性较大。以小鼠模型为例,其ACE2基因与人类的ACE2(hACE2)同源性较低,不能与SARS-CoV-2的S蛋白结合。通过CRISPR-Cas9技术敲入hACE2的转基因小鼠在SARS-CoV-2感染过程中往往呈现出重度感染症状,且hACE2在小鼠体内的过表达还使得SARS-CoV-2感染部位与人类的被感染器官不同[2],如通过滴鼻对转hACE2的小鼠进行攻毒,甚至在脑部也出现了SARS-CoV-2感染。其他的动物模型如仓鼠本身具有一定的ACE2表达,通常用作轻度感染模型,而与人类基因组非常接近的灵长类动物尽管是公认的最适合做药物评价的动物模型,但自2020年以来价格飞速上涨,目前恒河猴的价格已经超过10万元/只。紧随新型冠状病毒而来的是猴痘病毒(MPXV),因此在生物医药领域亟需一种可进行高通量筛选并能够真实反应人体组织状态的新型药物评价模型。
人源细胞特别是表达了特定靶点蛋白的人源细胞株通常被用于高通量的药物筛选,但这种2D纯培养模型很难反应药物的生物利用度、转运及代谢。原代细胞培养、干细胞分化、器官芯片以及3D培养等技术的发展使得新型药物筛选模型的开发在过去几年飞速发展。在肺脏体外模型(in vitro model)领域,精细切割肺切片(precision-cut lung slices, PCLS)、肺脏类器官、3D组织及肺芯片(lung-on-chip, LOC)等在药物筛选中已有成功实施案例。这些体外模型与动物模型在组成和功能上的比较如图2所示[3]。对于SARS-CoV-2的相关研究,类器官在可感染性、细胞异质性、3D微环境、通量及稳定性方面有着独特的优势。
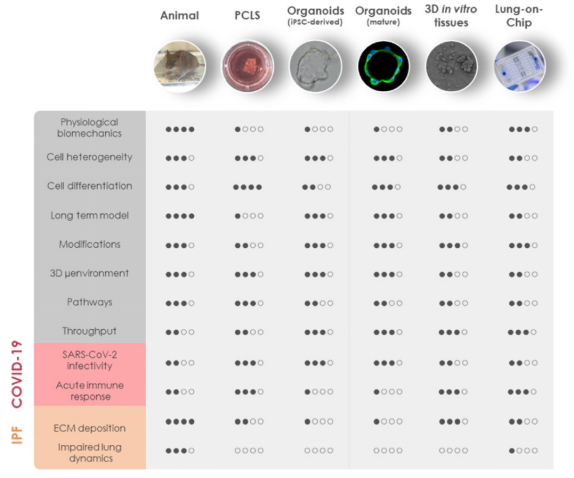
图2 新型冠状病毒研究中体内及体外3D模型的比较[3]
类器官(organoid)是通过多能干细胞及特定组织干细胞诱导分化产生的含有组织多种细胞的3D细胞培养物,可在体外模拟特定器官的结构和功能,具有发展成高通量药物筛选模型的潜力。类器官的培养过程如图3所示[4]:从人体或动物组织中分离得到的成体干细胞(ASCs)以及诱导多能干细胞(iPSCs)经过液体深层培养、气液界面培养或生物反应器培养可以得到类器官,基质胶(Martrix gel)的加入有助于不同形态及结构类器官的形成,在此基础上还可以在类器官中形成血管。类器官技术的快速发展为新药筛选中类器官模型的建立提供了很好的技术支撑。
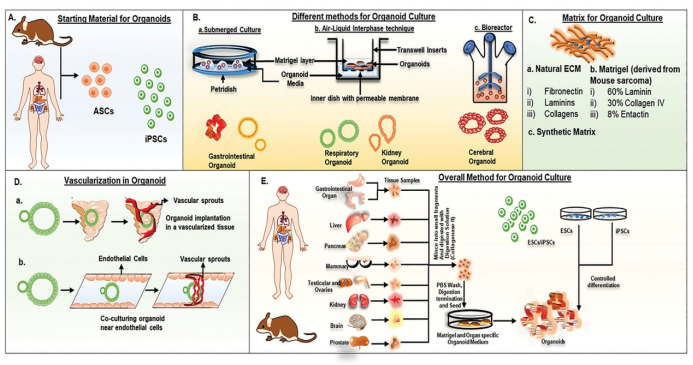
图3 类器官的培养过程及相关技术[4]
为了更好的反映SARS-CoV-2的感染过程及肺部组织的变化,进而对药物进行筛选和评价,很多实验室对现有的肺脏多细胞培养模型(multicellular model)进行了优化。Krüger等从多能干细胞分化得到小肠类器官,对瑞德西韦(Remdesivir) 和活性肽EK1抗SARS-CoV-2感染的活性进行了评价[5]。Monteil分别使用诱导性多能干细胞(iPSC)和人类胚胎干细胞构建了微血管类器官和肾类器官[6],如图4所示:
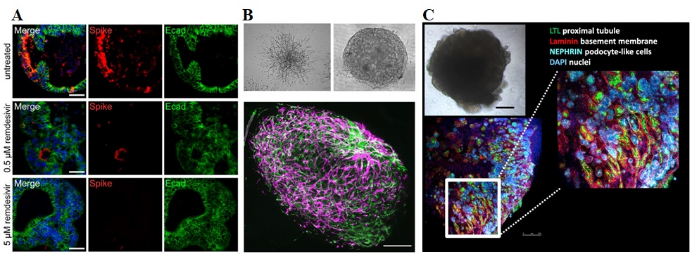
图4 研究SARS-CoV-2感染的类器官模型[5,6]
A. 瑞德西韦对SARS-CoV-2感染小肠类器官的抑制作用(蓝色:DAPI;红色:S蛋白;绿色:Ecad)[5];
B. 微血管类器官(绿色:CD31;紫色:PDGFRβ)[6];
C. 肾类器官(绿色:LTL;红色:laminin;青绿色:nephrin;蓝色:DAPI)[6]。
肺脏类器官在SARS-CoV-2的研究中扮演者非常重要的角色,多家实验室已经构建了肺脏类器官并对构建过程、评价方法及SARS-CoV-2感染后的细胞分化进行了探索[7-9],但目前在类器官中尚未实现肺泡的伸缩及呼吸功能。Zang等在小肠类器官中分别敲除TMPRSS2和TMPRSS4,结果显示后者可能在SARS-CoV-2的感染过程中发挥了更大的作用[10]。此外,通过CRISPR技术将荧光蛋白报告基因转入类器官构建的类器官文库可以广泛用于药物的筛选[11]。 类器官所具有的细胞自组装、多细胞免疫应答及通讯、基因编辑可操作性等特点使得其在在未来会成为新药研发领域强有力的工具[12]。
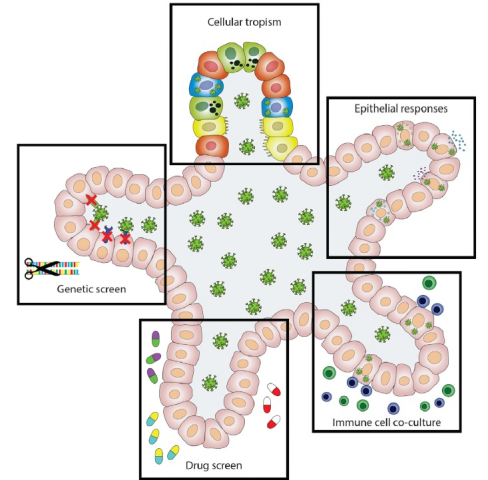
图5 类器官在抗病毒研究中的应用[12]
展望:
除抗病毒药物筛选外,我们还注意到类器官已经广泛应用于抗肿瘤药物的筛选。Michels等使用CRISPR-Cas9技术对APC-/-,KRASG12D 突变肠类器官进行编辑从而对肿瘤抑制基因进行了筛选[13],Ringel等则在野生型及APC突变的类器官中对TGF-β抗性的激动剂进行了筛选[14]。类器官有望成为新药研发领域的新一代模型。
北京爱思益普生物科技股份有限公司(ICE)致力于建立全面的靶点筛选和体外生物学研究平台,建立一系列基于生物学和药理学的研究技术集群,为客户提供涵盖各种靶标和疾病领域的新药研发服务。目前公司已经建立了100+离子通道,100+GPCR,800+酶学靶点以及40+核受体筛选细胞系及验证方法,涵盖了大部分成药性靶点,在国内具有竞争优势。针对类器官平台,公司在3D培养及药物筛选领域积极布局,目前已经建立成熟的3D培养及相关靶点检测管线。
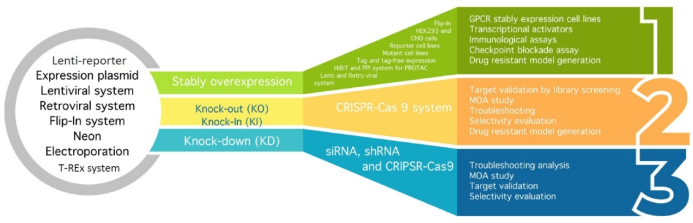
在细胞工程领域,爱思益普在稳转细胞系构建、KO、KI及KD等方向已经建立成熟的平台,为接下来在“类器官+基因编辑”的新一代药物筛选模型打下了坚实的基础。
参考文献:
[1]. de Oliveira M, De Sibio MT, Costa FAS, et al., Airway and Alveoli Organoids as Valuable Research Tools in COVID-19. ACS Biomater Sci Eng. 2021, 7(8), 3487-3502.
[2]. Meganck R.M & Baric R.S, Developing therapeutic approaches for twenty-first-century emerging infectious viral diseases. Nat. Med. 2021, 27, 401–410.
[3]. Kiener M, Roldan N, Machahua C, et al., Human-Based Advanced in vitro Approaches to Investigate Lung Fibrosis and Pulmonary Effects of COVID-19. Front Med (Lausanne). 2021, 8, 644678.
[4]. Rauth S, Karmakar S, Batra SK, et al., Recent advances in organoid development and applications in disease modeling. Biochim Biophys Acta Rev Cancer. 2021, 1875(2), 188527.
[5]. Krüger J, Groß R, Conzelmann C, et al., Drug Inhibition of SARS-CoV-2 Replication in Human Pluripotent Stem Cell-Derived Intestinal Organoids. Cell Mol Gastroenterol Hepatol. 2021, 11(4), 935-948.
[6]. Monteil V, Kwon H, Prado P, Inhibition of SARS-CoV-2 Infections in Engineered Human Tissues Using Clinical-Grade Soluble Human ACE2. Cell. 2020, 181(4), 905-913.e7.
[7]. Tindle C, Fuller M, Fonseca A, Adult stem cell-derived complete lung organoid models emulate lung disease in COVID-19. Elife. 2021, 10, e66417.
[8]. Ekanger CT, Zhou F, Bohan D, et al., Human Organotypic Airway and Lung Organoid Cells of Bronchiolar and Alveolar Differentiation Are Permissive to Infection by Influenza and SARS-CoV-2 Respiratory Virus. Front Cell Infect Microbiol. 2022, 12, 841447.
[9]. Han Y, Duan X, Yang L, et al., Identification of SARS-CoV-2 inhibitors using lung and colonic organoids. Nature. 2021, 589(7841), 270-275.
[10]. Zang R, Gomez Castro MF, McCune BT, et al., TMPRSS2 and TMPRSS4 promote SARS-CoV-2 infection of human small intestinal enterocytes. Sci Immunol. 2020, 5(47), eabc3582.
[11]. Beumer J, Puschhof J, Bauzá-Martinez J, et al., High-Resolution mRNA and Secretome Atlas of Human Enteroendocrine Cells. Cell. 2020, 181(6), 1291-1306.e19.
[12]. Geurts MH, van der Vaart J, Beumer J, et al., The Organoid Platform: Promises and Challenges as Tools in the Fight against COVID-19. Stem Cell Reports. 2021, 16(3), 412-418.
[13]. Michels BE, Mosa MH, Streibl BI, et al. Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids. Cell Stem Cell. 2020, 26(5), 782-792.e7.
[14]. Ringel T, Frey N, Ringnalda F, et al. Genome-Scale CRISPR Screening in Human Intestinal Organoids Identifies Drivers of TGF-β Resistance. Cell Stem Cell. 2020, 26(3), 431-440.e8.
地址:北京市通州区科创十三街与经海路交汇处
电话:010-67809840
邮箱:services@ice-biosci.com
官网:http://www.ice-biosci.com/

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



