News Detail
 来源:本站
来源:本站
 浏览量:19856
浏览量:19856
溶媒开发是药物发现和开发中不可或缺的一部分。这些制剂主要是为处于发现阶段和临床前阶段的药物化合物制备的,并通过各种途径如静脉或灌胃给药于动物。这些制剂的主要目的是获得足够的体内暴露,以便在广泛的成药性筛选和评价(包括药理学、药代动力学PK和毒理学)上选择、优化和改进化合物。药代动力学(PK)研究是为了评价药物在人和动物体内的吸收、分布、代谢和排泄(ADME)的过程。在PK研究的整个操作步骤当中,溶媒开发是整个实验的第一步,溶媒选择的成功与否直接关乎到候选化合物后续实验是否顺利推进。

图1 药物化合物在不同溶媒中的溶解度(A的澄清度最差,D具有最佳的澄清度)
溶媒开发策略
当客户确定一个方案后,根据实验方案可以得知化合物以及实验的相关信息,包括研究目的、剂量、给药途径、制剂要求、动物种属、药物化合物状态等。溶媒的选择以及用量与化合物的性质有关,若已知药物化合物结构或者相关理化性质如解离常数(pKa)、表面特性、吸湿性、水中溶解度等,这些参数可以对溶媒的选择提供一些指导作用。如利用化合物结构中的亲水基团或者疏水基团可以对化合物的水溶性作初步判断。
此外,溶媒的选择需要考虑到实验动物的种属、大小、给药剂量以及给药方式等各种要求,从而确定最终的配方比例。其中,给药方式是溶媒选择时考虑的重点,因为其对溶媒的状态要求不同,以IV和PO的溶媒开发途径为例:
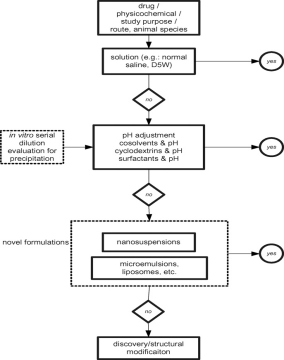
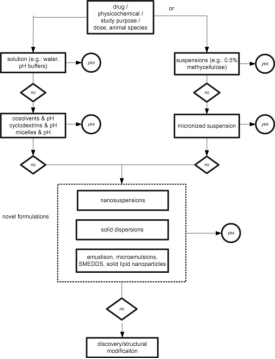
图2 IV的溶媒开发途径、图3 PO的溶媒开发途径
综合IV和PO 给药的溶媒开发,我们在选择溶媒时,一般考虑顺序为:单一溶媒-调节pH -助溶剂-表面活性剂-新配方。
1、单一水性缓冲液作为溶媒:如水,生理盐水,pH2~9的buffer等。
2、调节pH:pH缓冲液适用于在生理pH值2~9下电离的弱酸或弱碱。药物配制时的pH值由药物溶解度和药物溶液稳定性决定,按照化合物的一般规律,碱性基团多时降低pH可以提高溶解度,酸性反之。需要注意的是:极端pH值可能会产生生物相容性问题,如组织刺激、药物沉淀。对于各种动物物种,期望制剂中的缓冲系统不会破坏动物全身循环中的pH/缓冲液平衡。一般来说,pH 2~9的范围是可以接受的。
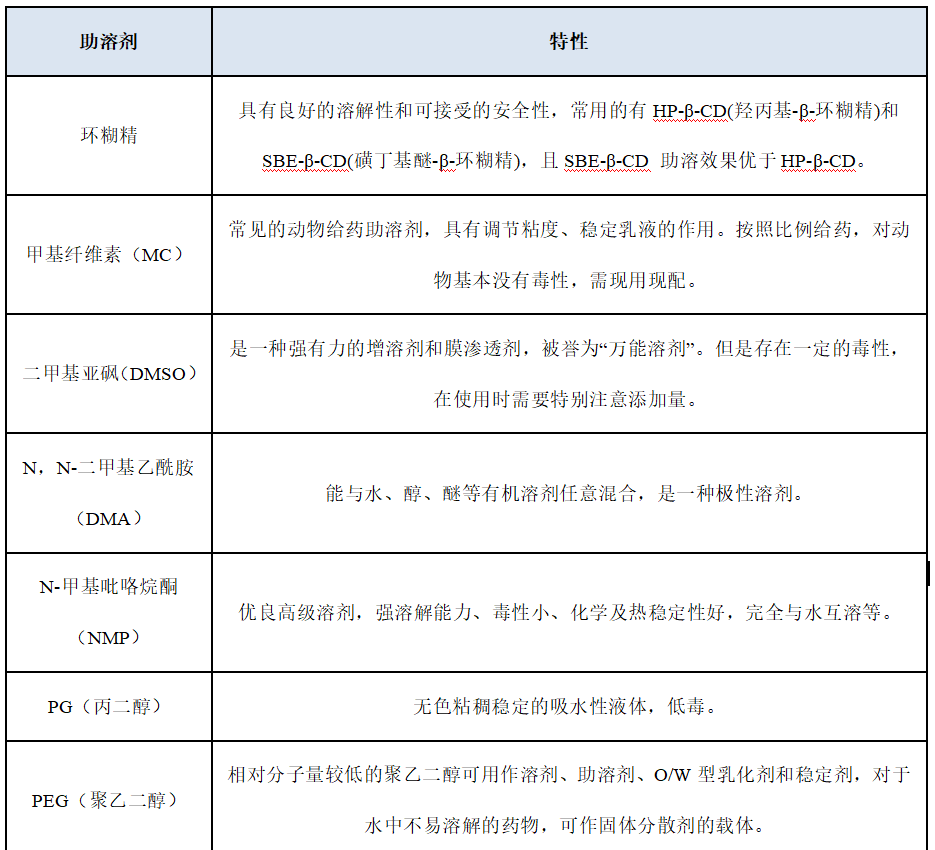
3、助溶剂:当使用单一溶媒不能完全溶解时,就需要考虑在配方中加入助溶剂,从而促进大多数水溶性差的药物化合物的溶解能力,保证药物在体内外的溶解性及稳定性,提高药物的溶出度和生物利用度。优先选择的助溶剂有环糊精、甲基纤维素(MC)等,极性较大的助溶剂有DMSO、N,N-二甲基乙酰胺(DMA)和N-甲基吡咯烷酮(NMP)等,极性稍小的助溶剂有乙醇、PG(丙二醇)和PEG(聚乙二醇)等,助溶剂与pH调节的联合使用可以显著增加药物的溶解度。
表1 几种常见的助溶剂
4、表面活性剂的使用:表面活性剂可以提高药物溶解度、改善药物颗粒润湿和溶解、减少或消除药物沉淀、减少药物降解、调节药物释放、促进药物更新等。表面活性剂以多种剂型使用:溶液、胶体体系(乳液、微乳液等)、胶囊/片剂等。常规的表面活性剂包括吐温80、聚氧乙烯蓖麻油(Cremophor EL)等。
①聚氧乙烯醚(35)蓖麻油(Cremophor EL):主要作为增溶剂,乳化剂,润湿剂,特别用于挥发油,脂溶性维生素及疏水性物质,作为非离子型表面活性剂,主要用于口服制剂,外用制剂和注射剂中。但是当静脉给药时剂量过高会导致在液质检测分析血浆时易产生大的基质效应。
②吐温80:易溶于水,溶于乙醇、植物油、乙酸乙酯、甲醇、甲苯,不溶于矿物油。低温时成胶状,受热后复原。吐温80具有很强的破裂细胞膜的作用而引起刺激性,溶血性和组胺释放(致敏性)。吐温80用于注射剂,会引起过敏反应,包括休克,呼吸困难,低血压,血管性水肿,风疹等过敏样反应症状。
表面活性剂的一个主要问题是会引起全身毒性,包括组胺释放和心血管副作用。并且,许多常规表面活性剂会干扰体内生物学过程,例如胃肠道渗透性增强、外排转运蛋白P-糖蛋白(P-gp)的抑制。因此,在溶媒开发中,表面活性剂适用于低剂量应用,且少量的表面活化剂可以最小化或消除潜在的药物沉淀。
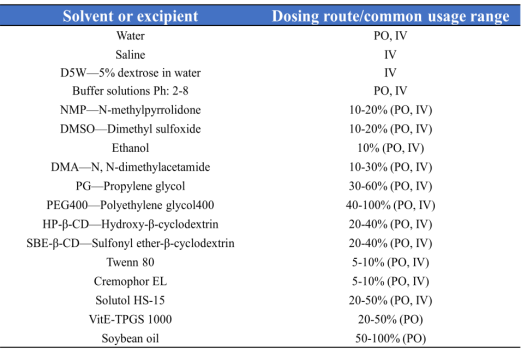
然而,配药并非给药,考虑到助溶剂和表面活性剂等的毒性,其用量应控制在尽量低的水平,表中是目前总结出来的一些溶媒使用的推荐范围。
表2 常见溶媒使用的推荐范围
药物沉淀潜力评估
给药(主要是注射)时的沉淀是溶液制剂的一个重大挑战,在没有确定的药物饱和时间的情况下,通常将配制好的vehicle在环境温度下放置24或48小时,观察溶液或混悬液的结晶情况。
为防止体外沉淀,一般措施为:
1、助溶剂之后再加水相,一般会减少超声时间,以防析出。
2、少量表面活性剂的存在干扰了结晶的形成,导致延迟、最小化甚至消除了结晶过程。因此,可以通过加入少量表面活性剂或甚至亲水聚合物来优化配方,以最小化或消除潜在的沉淀。
3、可以使用系列稀释法在体外沉淀中评估制剂,确保药物在注射前和注射时保持溶解。
4、现配现用,尽可能在动物给药前制备新鲜的制剂。
5、选择合适的储存环境。如储存温度,避光等。
在具体实验操作中,不仅要考虑药物是否溶解,还要考虑到各种添加物质在动物体内的耐受剂量范围、溶剂是否需要等渗、是否会在体内析出、配制药液的稳定性等多方面的问题。
下面提供了一些配方和适合的给药方式作为选择参考:
表3 常用配方

需要注意的是:在配药过程中,要按照配方顺序依次加入,且每加入一种溶剂,都要充分振荡,或者辅助加热、超声、调节PH等手段,以确保溶液溶解为均一状态。
案例一:
圣草酚能抗菌、抗炎,在糖尿病的发病机制中起着至关重要的作用,可以抑制 immunoglobulin E(Ig E)/antigen (Ag)诱导I型过敏反应,同时具有止痛及温热功效。大鼠口服两种溶媒配制的相同剂量的圣草酚后,结果发现以1%羧甲基纤维素钠(CMC-Na)为溶媒配制成混悬液给药与以75%生理盐水+20% PEG400+5%Tween80为溶媒配制成溶液形式给药的药代动力学行为存在显著差异。当给药剂量都为25mg/kg时,将给药溶液状态由混悬液变为澄清溶液后,可以明显观察到药物在体内的达峰时浓度Cmax明显升高。由此研究表明,溶媒的选择会对体内在体内的药代动力学行为有一定影响。
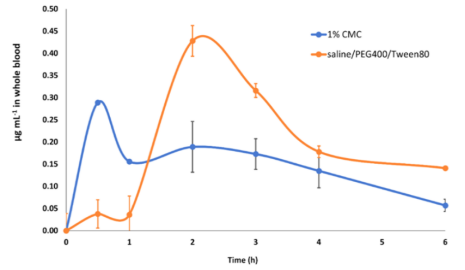
图4 大鼠口服混悬液或溶液后全血中黄酮葡萄糖醛酸的动力学曲线[8]
案例二:
奥拉帕尼(Olaparib)是聚二磷酸腺苷核糖聚合酶(PARP)抑制剂,已被证明在体外可以抑制选定肿瘤细胞系的生长,并减少人类癌症小鼠异种移植模型中的肿瘤生长。使用不同的溶媒配制相同剂量,发现Olaparib在混悬液(0.5% MC)给药与溶液(10%DMSO+60%PEG400+30%Water)给药的药代动力学存在显著差异。将给药溶液状态由混悬液变为澄清溶液后,可以明显观察到药物的达峰时间Tmax提前,且达峰时浓度Cmax明显升高,药时曲线下面积AUC和生物利用度F也明显提高,说明药物的溶媒改变可以显著影响药物的吸收,进而影响药物在体内的代谢和排泄。
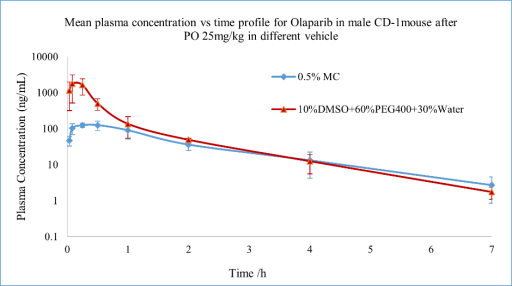
图5 Olaparib在雄性小鼠体内的药代动力学研究
爱思益普具有经验丰富的DMPK团队,建立了新药研发中临床前期的体内PK及体外ADMET相关实验,体内PK实验包括啮齿类的大小鼠PK实验非啮齿类比格犬的PK实验、急性毒性实验、毒代实验等,支持多种溶媒的使用、多种给药方式给药、多种组织取材等。体外ADME实验包括药物溶解度实验、Log D、Log P值实验、肝微粒体和肝细胞代谢、抑制和诱导实验、PPB血浆蛋白结合(HTD和超离)实验、Caco2/PAMPA实验、Transporter等实验,ICE可以提供定制化的体内体外相关实验,更好的为客户提供药代动力学服务,助力新药研发。
结合早期靶点验证与机理研究的平台、酶学和细胞学的筛选平台、成药性评价的ADMET平台、PK/PD的分析平台、谱学筛选平台(kinase panel, safety panel, cell panel, etc.)等,爱思益普可以更好的为药物研发的团队高效地提供药物构效关系测试,加速中国新药研发项目的进程。
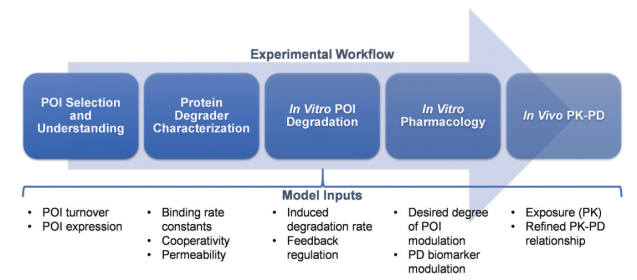
A proposed translational PK–PD roadmap for protein degrader therapeutics
(Bartlett, D. W. and A. M. Gilbert (2022). Chem Soc Rev 51(9): 3477-3486.)
参考文献
[1] Li P, Zhao L. Developing early formulations: practice and perspective. Int J Pharm. 2007 Aug 16;341(1-2):1-19.
[2] Dorr RT. Pharmacology and toxicology of Cremophor EL diluent. Ann Pharmacother. 1994 May;28(5 Suppl):S11-4.
[3]李晓鸽,邵燕,于雁灵.UPLC-MS法用于吐温80的含量测定与稳定性研究[A].中国化学会.中国化学会第22届全国色谱学术报告会及仪器展览会论文集(第一卷)[C].中国化学会:中国化学会,2019:164.
[4] Kerns EH, Di L, Carter GT. In vitro solubility assays in drug discovery. Curr Drug Metab. 2008 Nov;9(9):879-85.
[5] Kumar S, Bhargava D, Thakkar A, Arora S. Drug carrier systems for solubility enhancement of BCS class II drugs: a critical review. Crit Rev Ther Drug Carrier Syst. 2013;30(3):217-56.
[6] Pandey V, Kohli S. Lipids and Surfactants: The Inside Story of Lipid-Based Drug Delivery Systems. Crit Rev Ther Drug Carrier Syst. 2018;35(2):99-155.
[7] Mysrayn Y de Freitas Araújo Reis, Renaly I de Araújo Rêgo, Rocha BP, et al. A General Approach on Surfactants Use and Properties in Drug Delivery Systems. Curr Pharm Des. 2021;27(42):4300-4314.
[8] Manthey JA, Ferreira PS, Cesar TB. Influences of Solubility and Vehicle Carriers on Eriodictyol Pharmacokinetics in Rats. J Agric Food Chem. 2022;70(15):4667-4676.

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



