News Detail
 来源:本站
来源:本站
 浏览量:13248
浏览量:13248
一、NSD蛋白家族的结构及生物学功能介绍
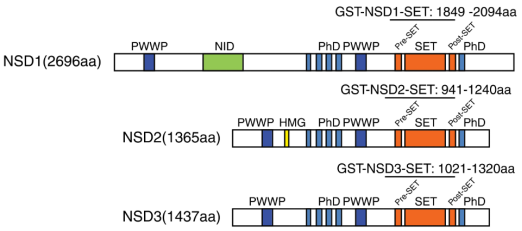
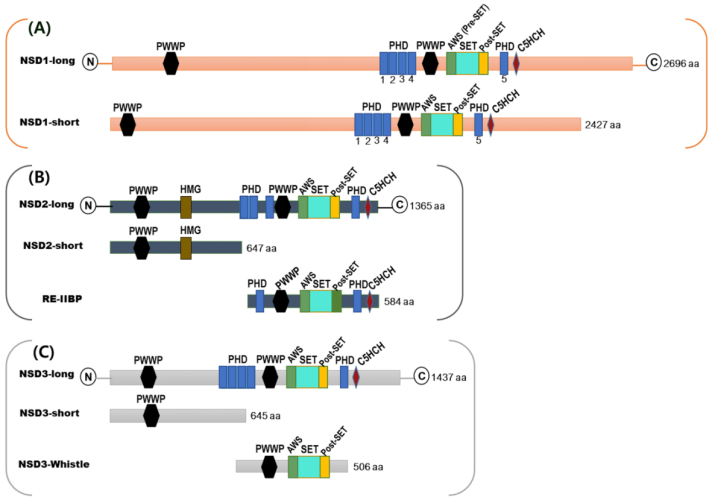
二、NSD蛋白家族与肿瘤的关系和靶向药物研究进展

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



