2022AACR会议上,Foghorn披露了个进入临床的SMARCA2/4的双抑制剂FHD-286的临床数据,将合成致死新成员SMARCA2/4再次引入新药研发重点研究对象行列中。SMAECA2/4是SWI/SNF复合物中非常重要的催化亚基,对于SWI/SNF活性至关重要,例如细胞代谢(包括药物代谢)、分化、发育、DNA修复、肿瘤生成、转移。DNA包裹在组蛋白的八聚体中形成核小体,相邻的核小体逐渐卷曲成致密的异染色质,阻断细胞活动,如转录、复制等。而染色体重塑,则会松弛染色质的致密结构,暴露出核小体中的DNA,促进转录调节因子的招募、基因转录、复制以及DNA修复等。SWI/SNF的功能主要是依赖其催化亚基的ATP水解产生的能量完成染色质的重塑,由此调控许多基因的转录,在肿瘤发生发展中具有抑癌基因的功能。SWI/SNF复合物包含12-15个亚基,这些亚基组合组装成数千个生化上不同的复合物。在发育过程中,SWI/SNF组成的变化可以驱动发育进展。同时,SWI
/
SNF复合物在许多人类恶性肿瘤中起肿瘤抑制作用。编码SWI/SNF复合物亚基的基因在大约20%的人类肿瘤样本中发生突变,是癌症中最常突变的复合物之一,这些突变在亚基中分布不匀,SMARCA2/4的突变比其他亚基更普遍。
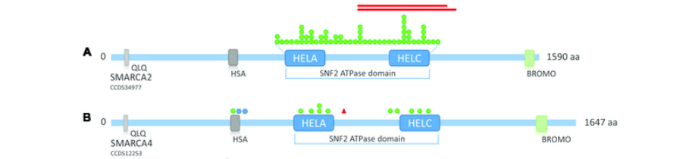
SMARCA2(BRM)/SMARCA4(BRG1)是SWI/SNF复合物中重要的两个互斥的催化亚基,都具有一个溴结构域和一个ATP水解酶结构域,具有75%的同源性,都有助于染色质重塑活性。然而,SMARCA2和SMARCA4在表达和功能上存在重要差异。SMARCA4在几种癌症类型中均有发生突变,而SMARCA2突变在癌症中很少见。研究表明,SMARCA4纯合突变体的小鼠不能存活,而SMARCA2/4中SMARCA4突变的小鼠,可以存活,存在“合成致死”关系。SMARCA2对于SMARCA4中具有功能丧失突变的肿瘤细胞生长至关重要,是SMARCA4突变癌症中关键且有希望的治疗靶点。此外,SMARCA4缺陷的患者群体通常缺乏可靶向的癌基因(如突变的EGFR或ALK易位),这进一步强调了开发SMARCA2抑制剂的潜力。
SMARCA4突变癌细胞依赖旁系SMARCA2,因此选择性SMARCA2抑制剂或降解剂可以诱导SMARCA4缺陷型癌细胞死亡。此外,
SMARCA4在很多缺乏可靶向癌基因的癌症中突变,包括10-20%的非小细胞肺癌、100%的小细胞卵巢癌、28%的皮肤癌、16%的胶质瘤以及14%的结肠癌等。
溴结构域是一种保守的结构基序,负责识别组蛋白尾部和其他转录相关蛋白上的乙酰化赖氨酸残基,在基因转录调节中有重要功能。同时,BET家族蛋白的溴结构域已经被证明是多种人类疾病的药物靶标,包括癌症和炎症。
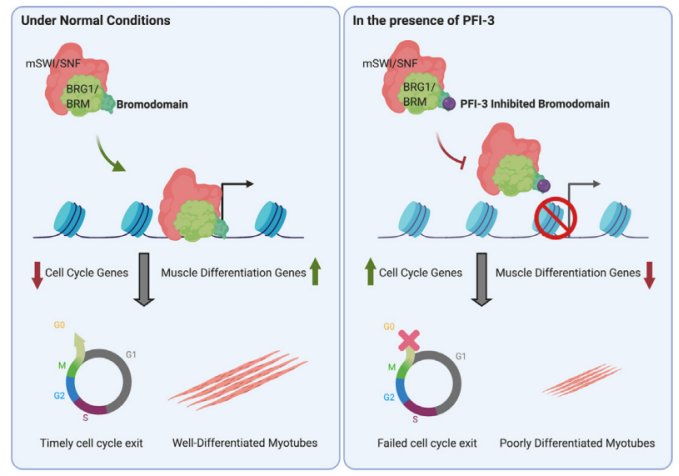
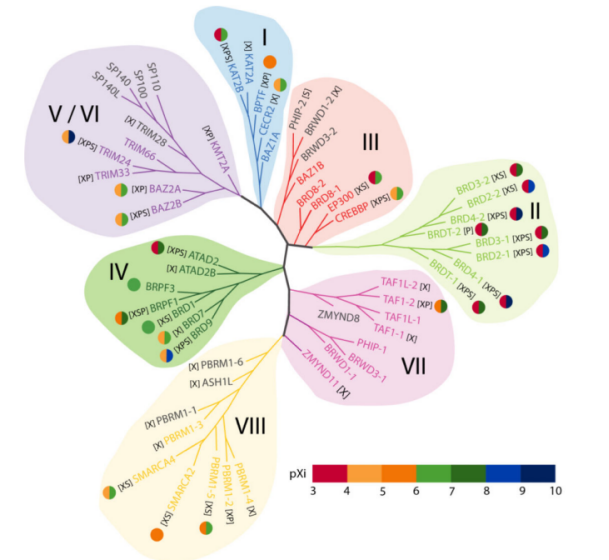 根据BRD全长序列将BRD家族分为8类。SMARCA2/4属于第8家族的成员,且SMARCA2/4有助于骨骼肌分化,激活致肌基因表达。SMARCA2有助于分化前成肌细胞的细胞周期停滞。正常情况下,当诱导肌肉分化时,需要具有活性溴结构域的SMARCA2/4与靶基因的启动子结合,使得细胞周期停滞和分化多核肌管形成;当SMARCA2/4溴结构域抑制剂存在时,SMARCA2/4与靶基因的启动子结合减少,导致细胞周期持续和分化不完全,导致肌管缩短。
根据BRD全长序列将BRD家族分为8类。SMARCA2/4属于第8家族的成员,且SMARCA2/4有助于骨骼肌分化,激活致肌基因表达。SMARCA2有助于分化前成肌细胞的细胞周期停滞。正常情况下,当诱导肌肉分化时,需要具有活性溴结构域的SMARCA2/4与靶基因的启动子结合,使得细胞周期停滞和分化多核肌管形成;当SMARCA2/4溴结构域抑制剂存在时,SMARCA2/4与靶基因的启动子结合减少,导致细胞周期持续和分化不完全,导致肌管缩短。
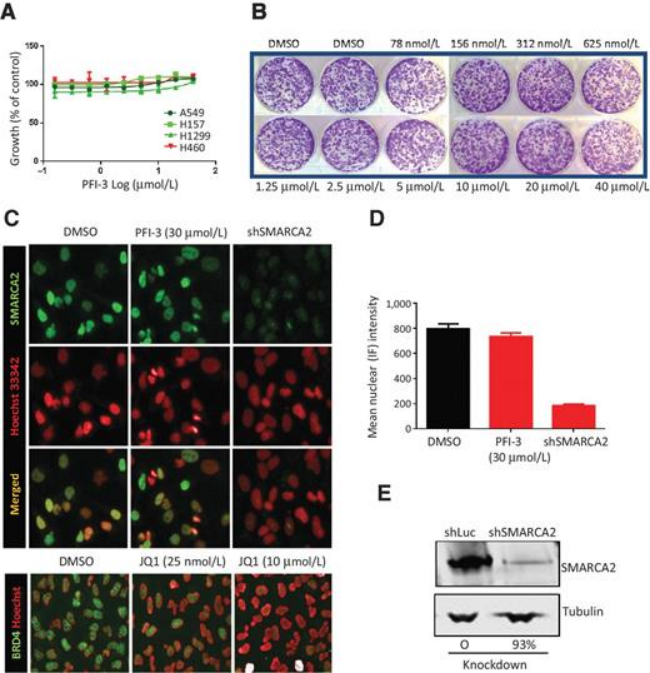
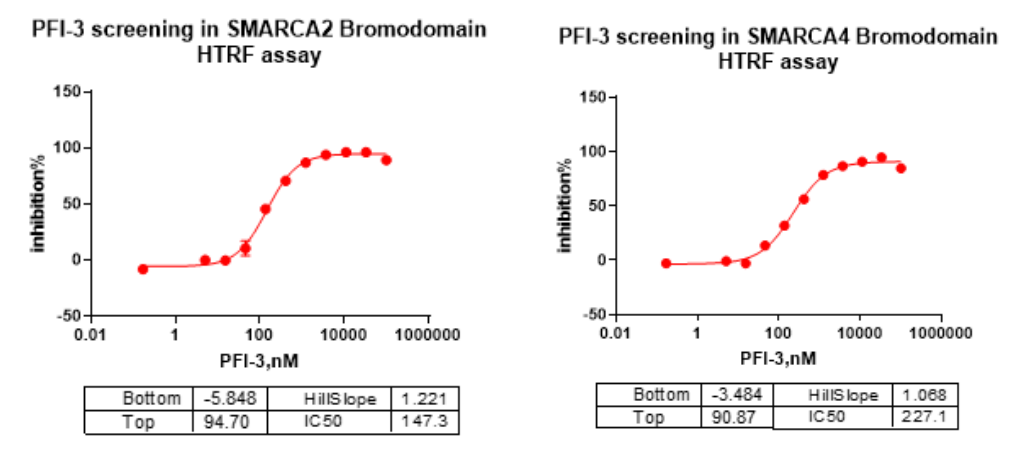
尽管SMARCA2/4溴结构域和骨骼肌生成有关,但是在癌症相关性方面,溴结构域功能并不十分重要。在SMARCA4缺陷品系(A549,H1299,H157)中评估了SMARCA2/4溴结构域抑制剂PFI-3,但在3天细胞活力中没有观察到抗增殖作用。由于SWI
/ SNF是一种含有许多染色质相互作用结构域的复合物,推测选择性SMARCA2溴结构域抑制本身不足以将内源性SWI /
SNF复合物从染色质中完全抑制。使用SMARCA2敲除株作为特异性对照,通过A549细胞中的免疫荧光监测内源性(全长)SMARCA2与染色质的结合,发现即使是高浓度的PFI-3依旧不影响SMARCA2和染色质的结合。这些数据表明,SMARCA2的溴结构域对于肺癌中的染色质结合和SWI
/ SNF致癌活性相关性不大。
 基于此报道,目前SMARCA2/4溴结构相关抑制剂研究并不多,更多的是将目光投放在SMARCA2/4的ATP水解酶活性上。染色质重塑利用几种基本机制,包括共价组蛋白修饰、ATP依赖性染色质重塑、组蛋白变体的利用和DNA甲基化。这些机制可以独立的工作或者协同工作,以实现最佳的染色质重塑,从而实现有效的转录调控、DNA复制和DNA损伤修复。
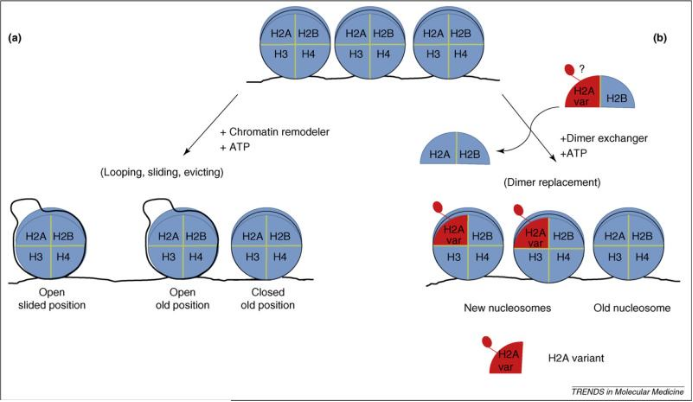
基于此报道,目前SMARCA2/4溴结构相关抑制剂研究并不多,更多的是将目光投放在SMARCA2/4的ATP水解酶活性上。染色质重塑利用几种基本机制,包括共价组蛋白修饰、ATP依赖性染色质重塑、组蛋白变体的利用和DNA甲基化。这些机制可以独立的工作或者协同工作,以实现最佳的染色质重塑,从而实现有效的转录调控、DNA复制和DNA损伤修复。SMARCA2/4染色质重塑有2个主要机制。第一种机制是利用ATP水解的能量产生“染色质重塑”,通常定义为核小体结构变化,主要涉及到DNA-组蛋白接触的解离(环联),核小体沿DNA的易位(滑动)或者是核小体的移动;这些变化可以开放或者暴露出染色质区域,从而增加DNA的可变性;第二种机制是利用ATP水解的能量来实现核小体亚基的“交换”,如H2A-H2B二聚体变为H2A变体-H2B二聚体,这些二聚体可以通过特定的翻译后修饰进行有效的转录调控。
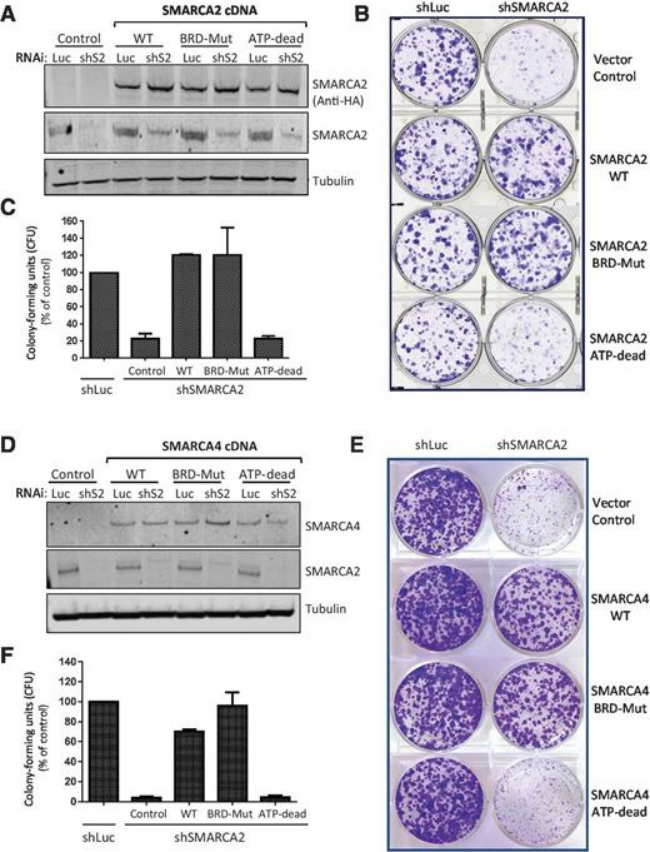
基于PFI-3研究,发现在SMARCA2的合成致死率和其ATP酶催化活性相关。在H1299细胞中设计了WT、ATP-Dead、BRD-Mut的SMARCA2细胞,发现SMARCA4缺陷的癌细胞不需要功能性的SMARCA2/4溴结构域也可生长,而ATP水解酶的催化活性是不可或缺的,意味着SMARCA2/4的ATP水解酶活性是更具有挑战性的小分子药物靶标。
目前有关SMARCA2/4
ATP水解酶活性抑制剂进展最快的是FHD-286,处于临床I期。临床前研究标明,该抑制剂用于治疗复发/难治性急性髓系白血病(AML)、骨髓增生异常综合征(MDS)和转移性葡萄膜黑色素瘤。但是在今年8月份,由于临床出现一名受试者死亡的严重不良反应时间,Foghorn
Therapeutics宣布FHD-286在AML/MDS的临床试验进行全部暂停,不过该药物用于治疗转移性葡萄膜黑色素瘤的I期试验以及正常进行。
此外,诺华、
Foghorn和Epizyme
等药企均在该靶点上布局,但目前公布的数据不多。除了小分子药物,基于SMARCA2/4的PROTAC研究也十分火热。不过,关于SMARCA2/4药物开发目前还有几个难点:(1)细胞内高浓度的ATP,使得竞争性抑制剂成为挑战;(2)ATP结合位点之间高的序列同源性;(3)虽然SMARCA2/4与其他ATP酶的同源性很少,但是SMARCA2和SMARCA4之间的同源性高,正常细胞的双重抑制可能会限制治疗窗口;(4)缺乏ATP结合蛋白的高通量筛选测定以及选择性组合。爱思益普目前已经开发出基于SMARCA2/4的溴结构域活性筛选平台,也开发出了SMARCA2/4的ATP水解酶活性平台,有助于筛选SMARCA2/4选择性的抑制剂。ICE也构建出SMARCA2/4
HiBiT cell line支持高通量的PROTAC领域的研究,并在进行体内相关模型的构建。爱思益普目前拥有强大的Drug
Discovery
Bioscience技术团队支持药物活性评价的一体化研究,在DNA损伤和修复、合成致死领域积极布局,如针对PRMT5,构建了HCT116-MTAP
KO细胞系,如细胞学层次上评价Wee1抑制引起的细胞周期变化、DNA损伤、CDK1、CDK2活化水平、细胞凋亡、Cell
panel筛选药物敏感细胞系等等维度的评价;结合PK-ADME的平台,可以评价药物对CYP3A4抑制,及成药性方面的优化;ICE的hERG筛选、KinomeOneTM217/ KinomeMAXTM416–kinase panel、SafetyOneTM 44/ SafetyMAXTM90 - Safety panel以及CardiacOneTM - Cardiac safety panel更能在选择性上和安全性上给予更多数据支持和研究。爱思益普专注创新领域,愿意与合作伙伴一同加速中国创新药物研发进程。SMARCA2/4体外检测服务: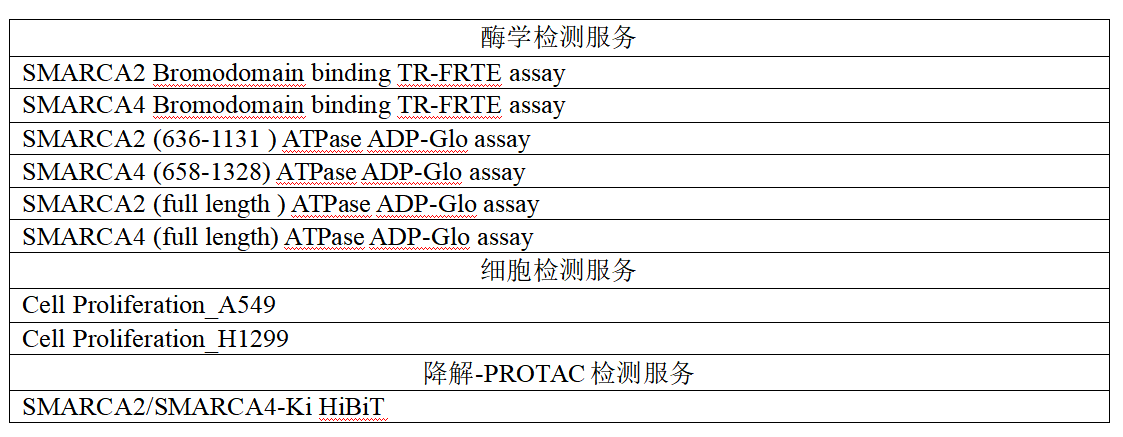 基于SMARCA2/4溴结构域筛选平台:
基于SMARCA2/4溴结构域筛选平台:
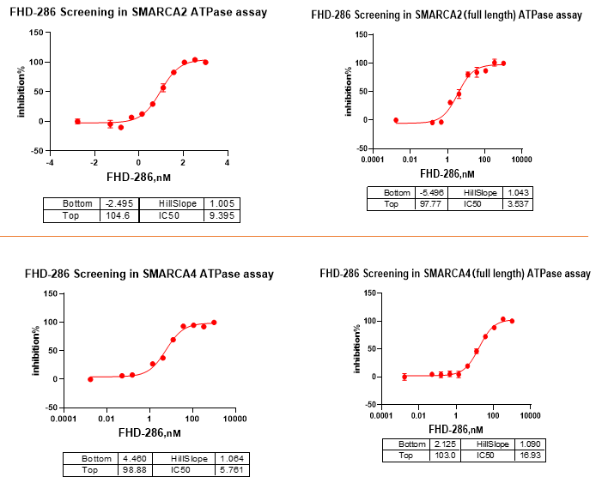
基于SMARCA2/4 ATPase筛选平台:
1.2022 AACR总结:最值得关注的小分子药物研发方向TOP102.https://pubs.acs.org/action/showCitFormats?doi=10.1021/acs.jmedchem.0c01242&ref=pdf.3.http://pubs.acs.org/action/showCitFormats?doi=10.1021/acs.jmedchem.8b013184.DOI:10.1126/science.aaz9761 (2020).5.DOI: 10.1002/cbic.2006005626.https://doi.org/10.1093/nar/gkab6177.https://pubs.acs.org/action/showCitFormats?doi=10.1021/acs.jmedchem.2c00662&ref=pdf9.DOI:10.1016/j.molmed.2007.07.004.10.https://doi.org/10.1016%2Fj.molmed.2007.07.00411.https://doi.org/10.1002/cbic.20060056212.https://www.nature.com/articles/s41598-018-20217-3#article-info13.https://doi.org/10.1158/1538-7445.AM2019-384414.DOI: 10.1038/s41589-019-0294-6.
地址:北京市通州区科创十三街与经海路交汇处
电话:010-67809840
邮箱:services@ice-biosci.com
官网:http://www.ice-biosci.com/
 来源:本站
来源:本站
 浏览量:14333
浏览量:14333