News Detail
 来源:本站
来源:本站
 浏览量:15896
浏览量:15896
G蛋白偶联受体(GPCRs)是真核生物中规模最大、种类最多样化的膜受体群。它们所调控生物的生理过程被证明与多种疾病相关,包括糖尿病、高血压、过敏、精神分裂症和阿尔茨海默氏病等疾病。GPCR也因此成为备受关注的成药靶点。截至2016年,获得了FDA批准的药物中有460种(36%)靶向GPCR,主要靶向A类GPCR。
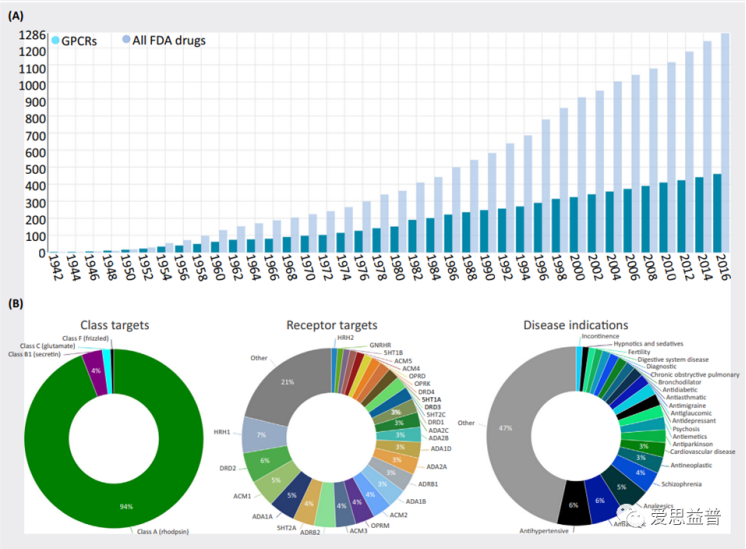
图1 PCRs成药靶点统计
尽管部分GPCR作为药物靶点是成功的,但很多GPCR并不存在有用的配体。GPCR由超过1000个基因编码,但只有一小部分的合成配体可用。这是由于传统的GPCR药物开发聚焦在靶向正位的内源性配体的结合位点上,而单个GPCR亚家族成员对特定内源性配体的原位结合位点通常高度保守,这使得很难对特定GPCR亚型实现高选择性,这无疑阻碍了针对单一GPCR亚型的高度特异性药物的设计。但是,GPCR除了内源性配体的结合位点之外还涉及许多蛋白-蛋白相互作用的信号网,如GPCR可能形成二聚体或更高阶寡聚体,或者它们参与了除公认的G蛋白相互作用之外的辅助蛋白质相互作用的过程,即GPCR的变构调节。
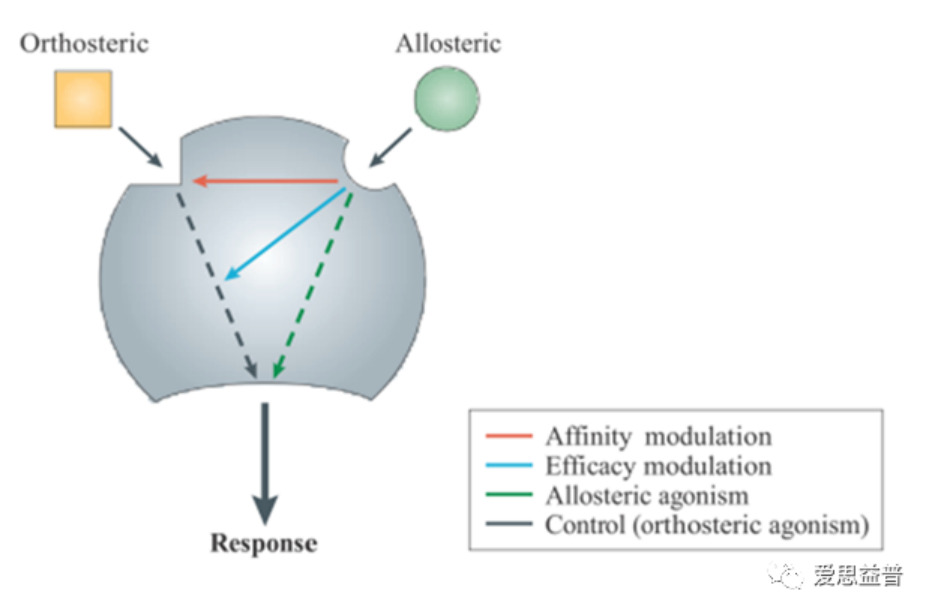
图2 变构调节机制
变构现象在生物学过程的研究中早已被发现,对蛋白来说,这种现象意味着一个区域(如变构位点,Allosteric site)可以与远距离的另一个区域的运动/能量相协同,并传递细胞内信号。通常,变构信号从变构位点到具有功能的正构位点的传递,是由变构位点的扰动来调节正向或负向蛋白质功能。这一机制通常具备以下几种优势:
不显示任何激动作用的变构调节剂在没有内源性正构活性的情况下是静止的,只有在正构激动剂释放存在的情况下才发挥其作用。因此,这种变构调节剂有可能维持内源性生理信号传导的时间和空间方面的活性依赖。
变构配体的第二个潜在优势是具有更广泛的受体选择性。因为相对于保守的正构域,受体亚型间变构位点有更高的序列差异性。
第三个优势是,变构调节剂具有有限的正向或负向协同性能力,将对其变构效应的大小施加一个“上限”。这一特性允许药理作用具有高度滴定性,大剂量的变构调节剂可以比正构激动剂或拮抗剂具有更低的靶向毒性。对于变构拮抗剂,这将表现为部分拮抗,反应会被降低到一个新的水平,但不会完全消除。当然,变构调节剂的这些潜在优势不适用于特定的治疗领域。
在过去几年内,我们也见证了配体靶向GPCR上的变构位点的发展,如2021年4月28日,刘剑峰教授团队与张岩研究员团队在Nature发表了题为“Structural basis of GABAB receptor-Gi proteincoupling”的文章,该研究突破性地鉴定了GPCR的C类异源二聚体GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构,在世界上首次揭示二聚体GPCR偶联G蛋白的新模式。
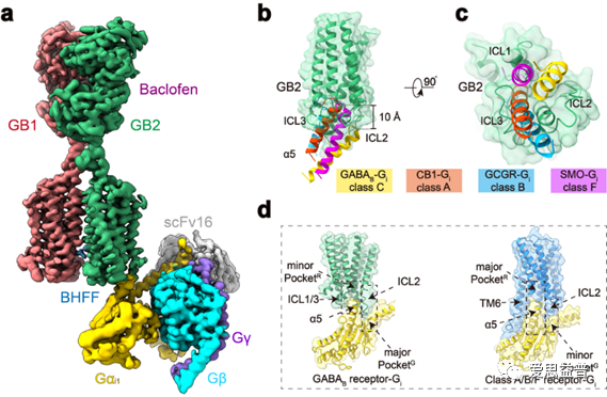
![]() 图3 GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构
图3 GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构
文章阐明了GABAB受体激活时的构象转变过程,鉴定了正向变构调节剂的结合位点,该研究还发现,由于潜在的空间位阻,二聚化的GABAB受体仅能偶联一个G蛋白。这极大地促进了GABAB受体的变构激活机制研究和靶向药物开发。此外,上海药物所的联合研究团队于6月16日在《Nature》上“背靠背”发表两篇相关论文,该研究针对C型GPCR的代谢型谷氨酸受体,发现不同受体(mGlu2,mGlu7)以不同方式形成同源二聚体将各自构象稳定在非活化状态,并且mGlu7对于二聚体组装和信号转导发挥主导作用。这是首次为mGlu异源二聚化的研究报道,对于进一步认识该家族受体异源二聚化分子调控机理奠定了坚实的基础。
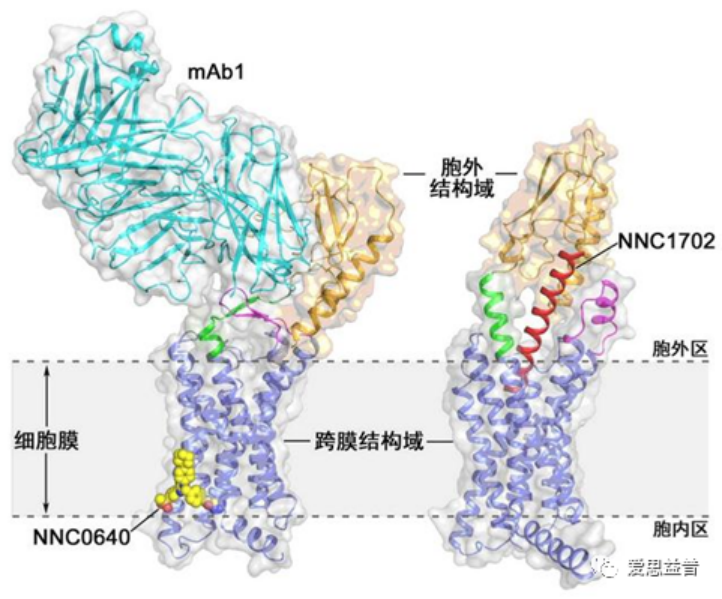
图4 GCGR蛋白与变构调节剂(NNC0640)和拮抗性抗体(mAb1)抗原结合片段结合的复合物晶体结构
同时,之前在2018年1月4日,该团队在《Nature》发表了关于B型G蛋白偶联受体结构与功能的研究进展:首次测定了胰高血糖素受体(Glucagon receptor, GCGR)全长蛋白与多肽配体复合物的三维结构,揭示了该受体对细胞信号分子的特异性识别及活化调控的机制。该团队解析了全长GCGR蛋白同时与一种小分子变构调节剂(NNC0640)和拮抗性抗体(mAb1)抗原片段结合的复合物晶体结构。首次在较高分辨率水平为人们呈现了全长B型GPCR蛋白的三维结构,揭示了该受体不同结构域对其活化的协作调控机制。该研究成果也为通过GCGR治疗2型糖尿病的药物研发提供重要的理论基础。
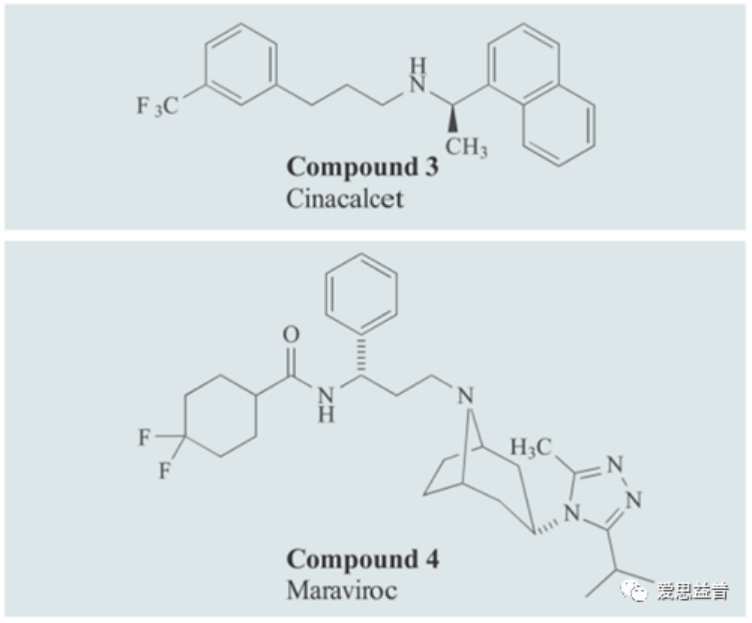
图5 已经进入市场的两种变构调节剂
现已有两种GPCR的变构调节剂进入市场,也让人们看到了这种新的GPCR调控模式的前景。一种是趋化因子受体CCR5的NAM(Nagetive allosteric modulators):Maraviroc。Maraviroc与CCR5结合,稳定了对HIV病毒亲和力较低的受体构象,从而阻止CCR5依赖型的HIV-1进入细胞。另一种是C型GPCR的钙感应受体(CasR)的PAM(Positiveallosteric modulators):Cinacalcet。它增加了CASR靶点对循环钙的敏感性,可用于治疗慢性肾病透析患者的继发性甲状旁腺功能亢进症。钙感应受体(CaSR)是一种C类G蛋白偶联受体(GPCR),在钙稳态和甲状旁腺激素分泌中起着重要作用。钙信号通路是多种细胞功能所必需的,钙感应受体(CaSR)是钙信号转导和维持钙稳态的重要组成部分。钙除了在信号转导过程中作为第二信使外,钙还可以作为被质膜上的受体直接感知的第一信使。一般来说,细胞外钙离子浓度的微妙变化可以被CaSR感知,CaSR在甲状旁腺高度表达,然后由分泌的甲状腺激素精确的调控通过骨骼、尿和肠道中钙离子的重吸收。CaSR的异常表达水平和受体活性将会导致许多疾病,如家族性低尿钙性高钙血症1型(FHH1)、新生儿严重甲状旁腺功能亢进(NSHPT)、常染色体显性遗传1型低钙血症1型(ADH1)和哮喘。
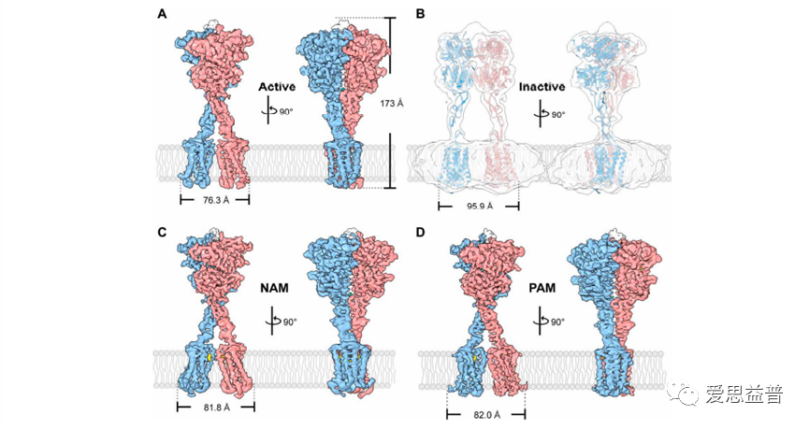
图6 四种不同条件下(激活态、负变构调节态、正变构调节态以及失活态)的全长CaSR的结构
CaSR是由细胞质膜中二硫键连接的同源二聚体,单拷贝的人类CaSR基因编码1078个氨基酸残基,整体结构可能与其他C类GPCRs相似。在对不同刺激的反应中,CaSR同型二聚体可以与各种配体和变构调节剂结合,然后通过G蛋白介导下游信号传导,包括Gq、Gi、G12/13和Gs。除了内源性变构调节剂如l-芳香族氨基酸,CaSR也可以被合成的变构调节剂调控,包括正向和负向变构调节剂。Cinacalcet,是一类称为拟钙剂的新型药物。该药使甲状旁腺中的钙敏感受体对细胞外钙敏感,并直接降低甲状旁腺激素水平。Evocalcet于2018年在日本首次获批,与Cinacalcet相比,Evocalcet具有强效阳性变构疗效,且胃肠道相关副作用小。合成分子NPS-2143是一种选择性和强效的CaSR拮抗剂,体内研究表明,在adh相关的小鼠模型中,NPS-2143显著增加了胞质钙和甲状旁腺素浓度。
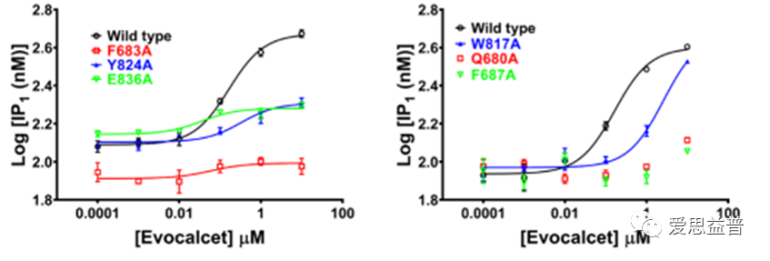
图6 正变构调节剂Evocalcet的IP1检测
迄今为止,已经确定了人CaSR在活性和非活性状态下的晶体结构。这些研究成果由南开大学杨雪/沈月全团队于2021年6月4日在Science Advances杂志上发表,题为Structural basis for activation and allosteric modulation of full-lengthcalcium-sensing receptor。该研究运用冷冻电镜的方法解析了四种不同条件下(激活态、负变构调节态、正变构调节态以及失活态)的全长CaSR的结构。同时,该研究也验证了正变构调节剂Cinacalcet的作用模式。
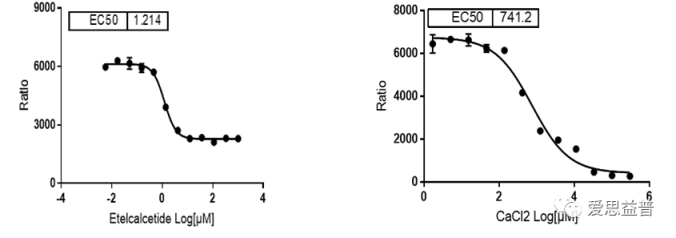
图7 爱思益普CaSR受体筛选
目前已有报道的18种GPCR与变构效分子的共晶结构,详见下表:
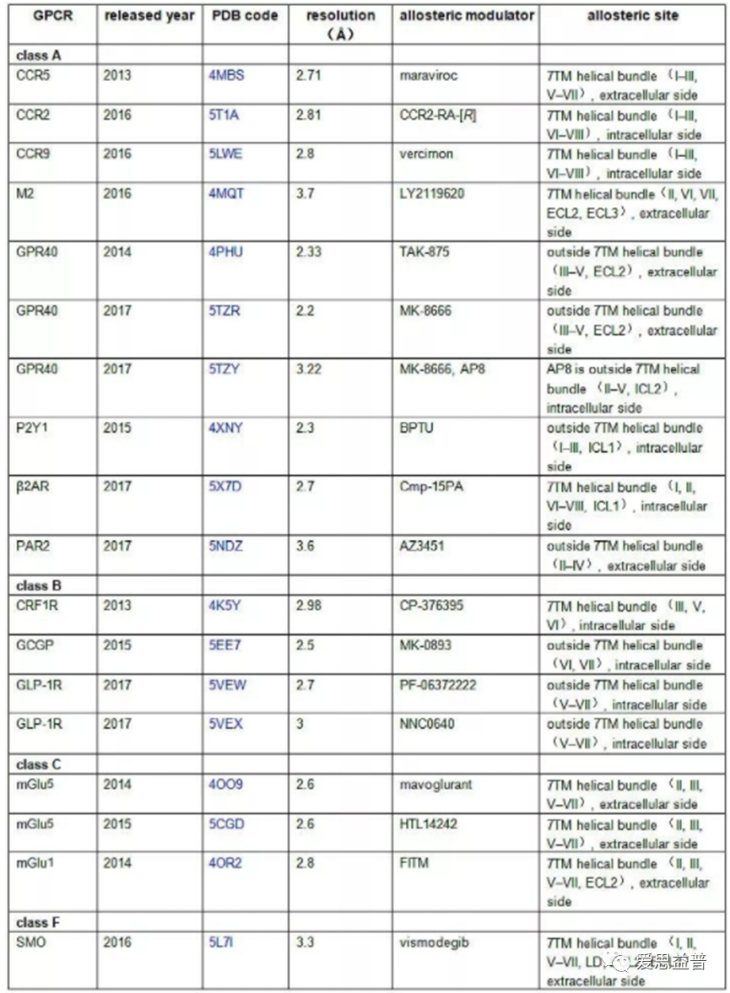
表1 18种GPCR与变构效分子的共晶结构
结束语
从创新药物研发的角度来看,GPCR的变构调节为靶标新型药物的出现提供了极具吸引力的前景。由于变构位点和正构位点(Orthosteric site)不处在同一位置,变构调节剂结合变构位点可上调和下调蛋白功能,并不和保守正构位点上的内源配体竞争,这一特点提供了激动型药物的普适开发方式。而且,相对于高度保守的正构位点,多样化的变构位点赋予了变构激动剂/抑制剂更好的选择性和更低的毒性。更为重要的是,蛋白中的变构抑制剂和正构抑制剂联用还可以对蛋白功能进行协同抑制,来降低药物耐药突变产生的可能。
毫无疑问的,GPCR变构调节药物的研发还有很长的路要走,但是随着科技的进步与研究成果的累积,这种独特的激活模式在新药研发中的前景必将一片大好。

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



