News Detail
 来源:2024-09-06 16:33:35
来源:2024-09-06 16:33:35
 浏览量:19345
浏览量:19345

一、爱思益普体外免疫筛选平台介绍
爱思益普拥有一支专业的免疫团队,搭建了多元化的体外免疫筛选服务平台,包括已经构建的常规筛选检测以及根据特定需求优化构建的各种免疫测试服务。
由于免疫相关实验的多样性和复杂性,基于实验目的,我们还提供针对特定需求的实验方法开发和优化,可以最大程度帮助客户找到合适的筛选和评价体系。
人体的免疫系统主要可分为固有免疫即先天性免疫和适应性免疫。其中固有免疫提供了机体防御外敌的前两道防线,第一道防线是由皮肤和黏膜构成,主要作用是阻挡病原体的侵入,分泌相应的物质如乳酸、脂肪酸等来杀菌;第二道防线是体液中的杀菌物质和相应的细胞成分包括上皮屏障和白细胞(中性粒细胞、巨噬细胞、NK细胞、具有不变抗原受体的淋巴细胞和肥大细胞)。适应性免疫主要由免疫器官和免疫细胞组成,构成了人体的第三道防线,其中免疫细胞主要包括T细胞和B淋巴细胞。
因此,肿瘤免疫治疗的重点在于,重新激活肿瘤免疫细胞,防止肿瘤细胞发生免疫逃逸。目前,针对固有免疫系统的药物包括TLR激动剂,STING激动剂,ENPP1、TREX1和PARP7抑制剂等,而ENPP1、TREX1和PARP7的抑制剂是通过间接激活STING通路起免疫调节作用。针对适应性免疫系统的药物开发主要以免疫检查点抑制剂为主。随着对T细胞内信号传导的深入研究,多种免疫检查点药物不断问世,其中最为瞩目的是PD1/PD-L1单抗,在肿瘤免疫治疗领域取得了突破性进展。但仍存在许多局限,如癌症患者对治疗无应答或者产生耐药等。因此突破PD-1的局限成为肿瘤免疫治疗领域药物研发的新需求。随着相关领域研究的不断深入,近年来也陆续发现了其他几个T细胞受体(TCR)下游的负反馈回路,通过抑制这些负反馈回路有可能增强T细胞的免疫活性。主要的研究靶点包括HPK1(造血祖激酶1)、DGK(二酰基甘油激酶)、PTPN2(蛋白酪氨酸磷酸酶1b)以及CBL-B(E3泛素蛋白连接酶)等(图1)。
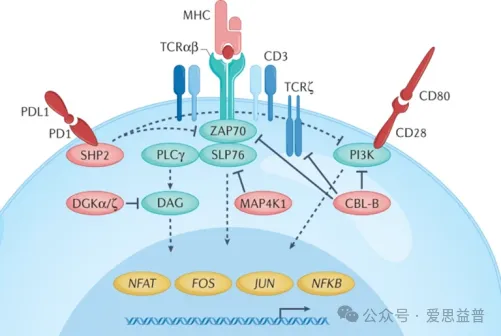
图1 参与免疫受体信号传递的胞内靶点 DOI: 10.1038/s41573-022-00538-9
HPK1是一种丝氨酸/苏氨酸激酶,仅在造血细胞类型中表达。它在多种细胞过程中发挥作用,包括免疫信号传导、细胞增殖、细胞死亡和铁代谢等。在免疫细胞信号传导过程中,HPK1参与T细胞受体(TCR)和B细胞受体(BCR)的信号传导途径, TCR刺激后,HPK1发生磷酸化,随后被募集到TCR信号复合体中,通过其丝氨酸/苏氨酸激酶功能诱导该复合体解离,起到负调控作用。 目前,处于临床研究阶段的HPK1靶向小分子抑制剂有10种,其中研究进展较快的是BeiGene Ltd.开发的BGB-115025,临床在研适应症为非小细胞肺癌、晚期恶性实体瘤、实体瘤、局部晚期非小细胞肺癌、转移性非小细胞肺癌、不可切除的非小细胞肺癌,其余9款在研药物尚在临床1/2期或1期研究阶段。除此之外,还有近40种处于临床前和药物发现阶段,开发的适应症主要为非小细胞肺癌、晚期恶性实体瘤、实体瘤、肌萎缩侧索硬化、阿尔兹海默症等。DGK是一类激酶,可以催化DAG磷酸化为磷脂酸。而DAG是磷脂酶Cγ1在TCR作用时产生的第二信使,触发信号级联,在T细胞发育和功能中起重要作用。DGK通过调节DAG的水平,参与免疫细胞如T细胞、B细胞、树突细胞等的信号传导,进而影响免疫细胞对肿瘤细胞的识别和反应。其中,DGKα和DGKζ在T细胞中显著表达 ,它们的表达和活性在TCR刺激下增强,而持续表达与肿瘤浸润T细胞的低反应性相关。目前临床在研的DGK小分子抑制剂有6种,其中进展较快的是Astellas Pharma Global Development, Inc.的ASP-1570,处于临床1/2期,主要适应症为晚期恶性实体瘤、实体瘤,其余几款皆在临床1期研究阶段。PTPN2属于酪氨酸磷酸酶家族成员之一,该家族成员广泛参与细胞内的信号传导过程,通过去磷酸化作用调节多种细胞功能,包括细胞生长、分化、迁移和免疫反应。研究发现,肿瘤细胞种PTPN2的缺失通过使肿瘤对IFNγ敏感,能增强免疫治疗的反应。此外,PTPN2的缺失还能增强T细胞的扩张、IL-2的免疫应答和抑制肿瘤生长的能力,这使得PTPN2靶向治疗可以通过直接作用于肿瘤细胞并增强免疫细胞的抗肿瘤活性来参与双重抗癌作用。然而,磷酸酶被认为是不可成药靶点,该类靶点的药物开发具有一定挑战性。目前处于临床在研阶段的药物仅一款由哈佛大学Broad研究所Robert Manguso团队的研究人员发现的ABBV-CLS-484 (AC484),该小分子抑制剂通过抑制PTPN2/PTPN1,使 T 细胞和 NK 细胞免疫活性增强,也使得肿瘤细胞更易遭受攻击。CBL-B(Casitas B细胞淋巴瘤-B)是一种E3泛素连接酶,它在调节T细胞的活化和免疫耐受方面起着关键作用。其主要功能包括:(1)T细胞活化的负向调节:CBL-B通过泛素化多种膜受体和辅助受体的下游蛋白来限制T细胞的活化。它与E3连接酶Itch协同作用,能够介导TCR-ζ的Lys33连接的多泛素化,阻止其磷酸化并进一步与下游ZAP70激酶结合,从而抑制T细胞活化;(2)免疫突触的调节:CBL-B在T细胞激活时被招募到TCR中,通过其多个蛋白质相互作用结构域与关键TCR信号体分子相互作用,从而抑制T细胞活化;(3)TCR内化的促进:CBL-B可以促进TCR的内化,它干扰激活和聚集,从而破坏免疫突触的稳定性,进一步减弱TCR信号;(4)T细胞免疫耐受的维持:CBL-B的表达对于维持外周T细胞免疫耐受至关重要,其缺失能克服内源性CD8+ T细胞的衰竭。在肿瘤免疫治疗领域,CBL-B被认为是一个有前景的治疗靶点。抑制CBL-B能够激活免疫监视并提高抗肿瘤效果。针对CBL-B的干预策略,如使用小分子抑制剂或基因敲除,可能为癌症治疗提供新的途径。当前处于临床研究阶段的CBL-B抑制剂有4种,其中Neuraptive Therapeutics的NTX-001和HotSpot Therapeutics的HST-1011在临床2期,前者的适应症为周围神经损伤,后者主要用于癌症治疗,包括晚期恶性实体瘤、复发癌、难治性癌症、B细胞淋巴瘤等。另外Nurix Therapeutics开发的2款抑制剂NX-0255和NX-1607皆在临床1期研究阶段,在研适应症主要集中在肿瘤治疗方面,如晚期癌症、子宫内膜癌、结直肠癌、弥漫性大B细胞淋巴瘤、胃食管交界处癌、恶性胸膜间皮瘤等。
表1. 部分临床在研小分子免疫检查点抑制剂
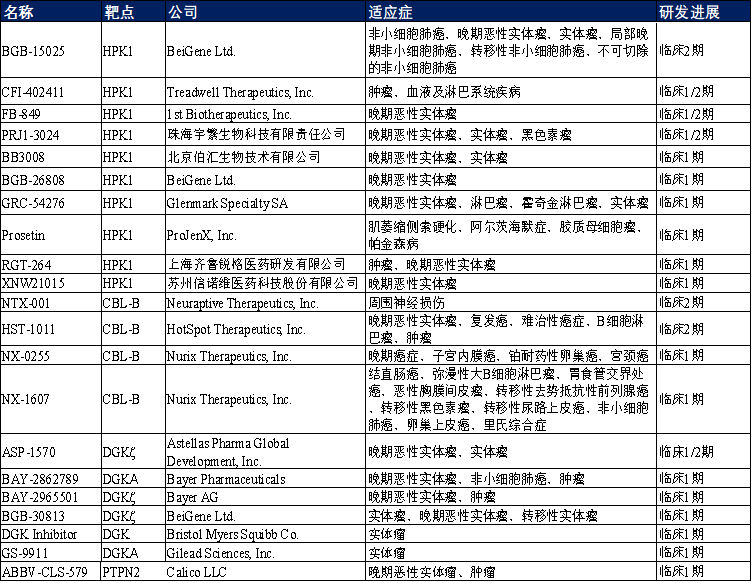
综上所述,当前已有众多小分子药物进入临床研发阶段,可作为单一疗法或与抗体药、传统化疗药相结合,有望进一步提高肿瘤治疗效果或改善检查点抑制剂耐药的问题,但尚未有已上市药物。因此,肿瘤免疫治疗领域相关靶点的药物研发仍处于快速发展阶段。目前ICE已经构建了从早期的生化检测到体外细胞功能测试非常完善的实验方案,助力推动新药的快速发现和筛选。以下将以CBL-B为例展示ICE在肿瘤免疫方面的检测平台。
三、爱思益普 CBL-B筛选平台介绍
1. CBL-B抑制剂生化检测平台
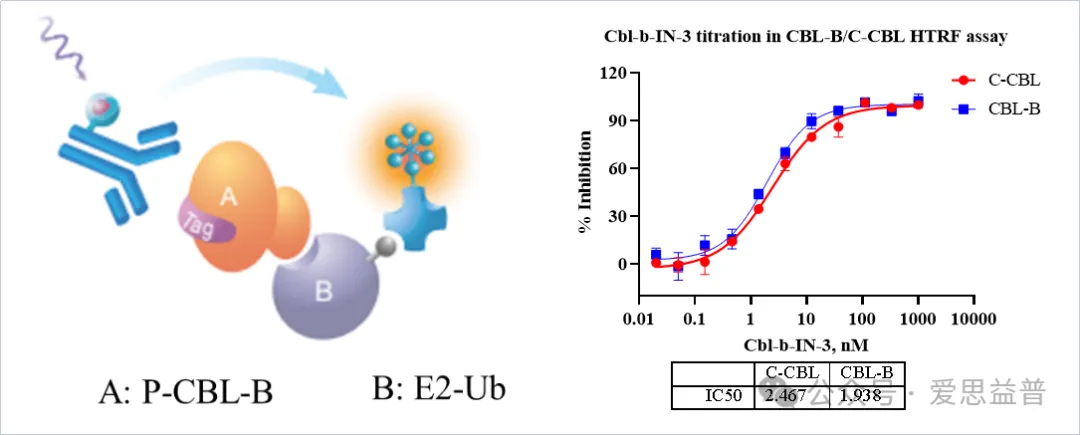
图2. CBL-B HTRF Assay
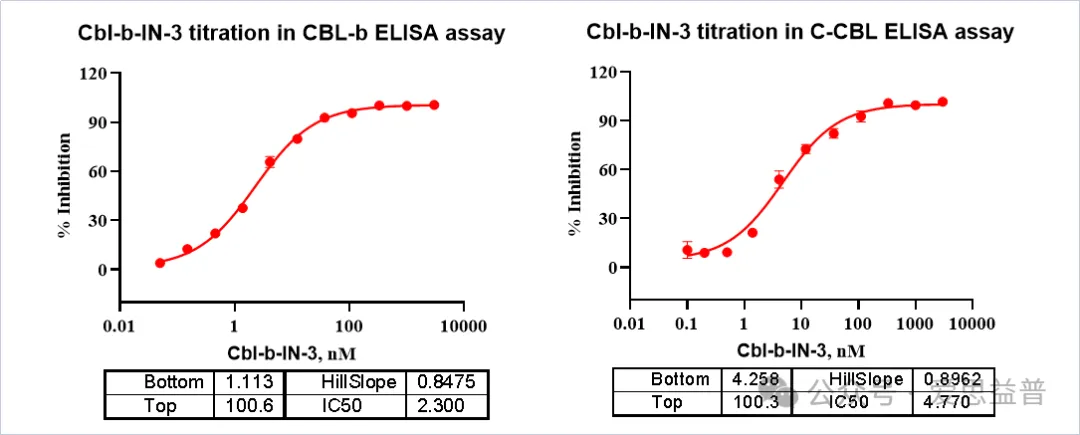
图3. CBL-B ELISA Assay

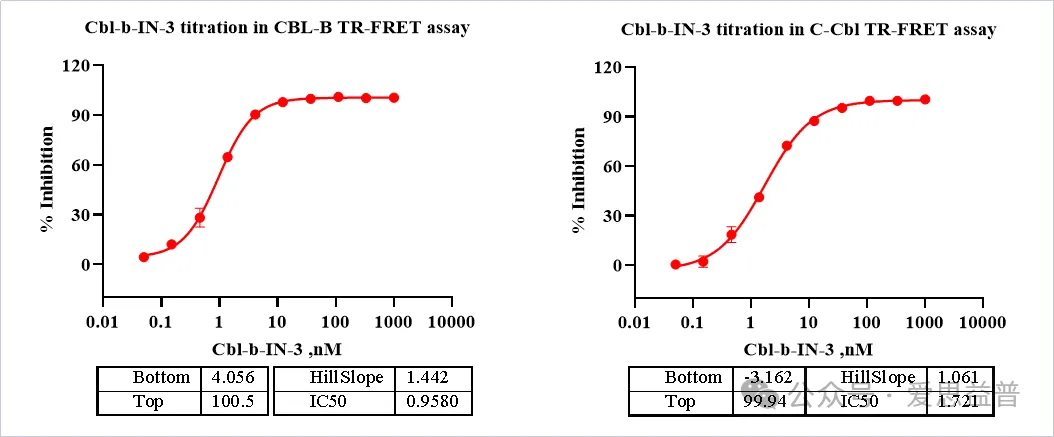
图4. CBL-B displacement assay
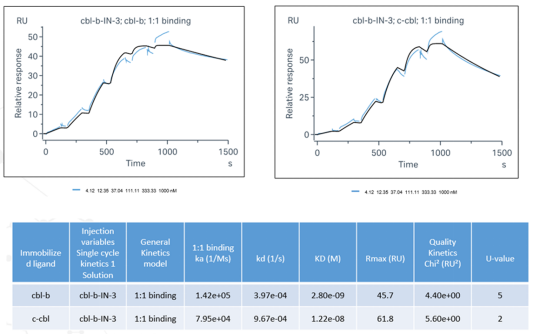
图5. SPR assay
2. CBL-b抑制剂细胞学检测平台
2.1 Reporter Assay
通过高通量筛选方式,在细胞水平进行检测,可以有效地筛选具有潜在活性的候选药物。爱思益普具有Jurkat-Lucia™ NFAT和Jurkat-IL2-LUC的报告基因细胞,可以有效地用于抑制剂的高通量筛选。另外,也构建了Jurkat NFAT CBL-B KO的报告基因细胞,用于CBL-B抑制剂的选择性测试。
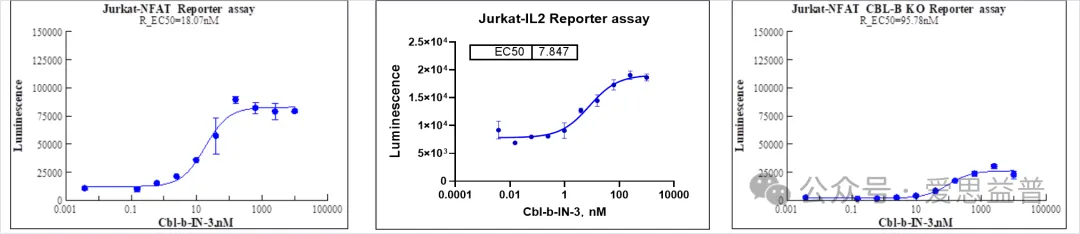 图6. 针对CBL-B抑制剂的Reporter assay(报告基因)测试
图6. 针对CBL-B抑制剂的Reporter assay(报告基因)测试
2.2 免疫细胞功能和机制的研究
尽管利用reporter细胞系进行高通量筛选能够快速识别潜在的活性分子,但由于原代细胞或特定疾病相关细胞具有独特的生物学特性和功能,它们在药物发现过程中的进一步验证是不可或缺的。通过在这些细胞上进行验证,研究人员可以更精确地评估化合物对其状态的影响,从而筛选出更具针对性和治疗潜力的化合物。目前爱思益普已经在免疫细胞中建立相关的检测手段:
2.2.1 T/B细胞的激活
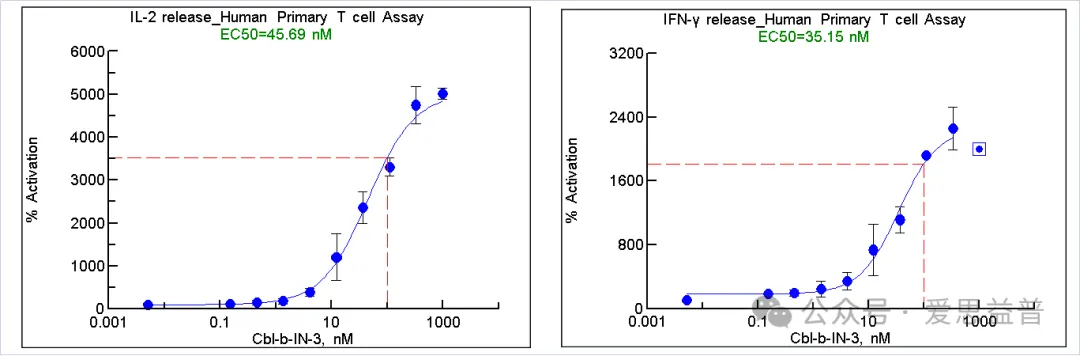 图7. 检测Human T细胞激活后IL-2, IFNγ的释放
图7. 检测Human T细胞激活后IL-2, IFNγ的释放
(2)Mouse T细胞激活后相关因子释放的检测、
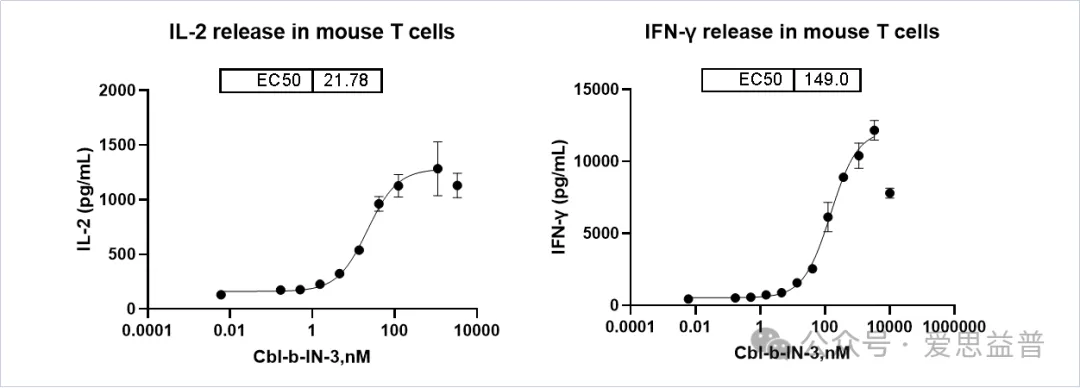
图8. 检测Mouse T细胞激活后IL-2, IFNγ的释放
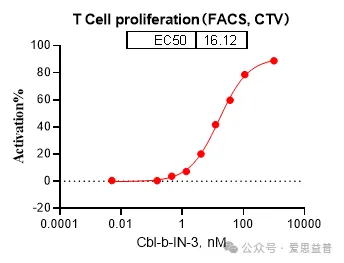
图9. T细胞的增殖检测
(4)T/B细胞表面Marker的检测
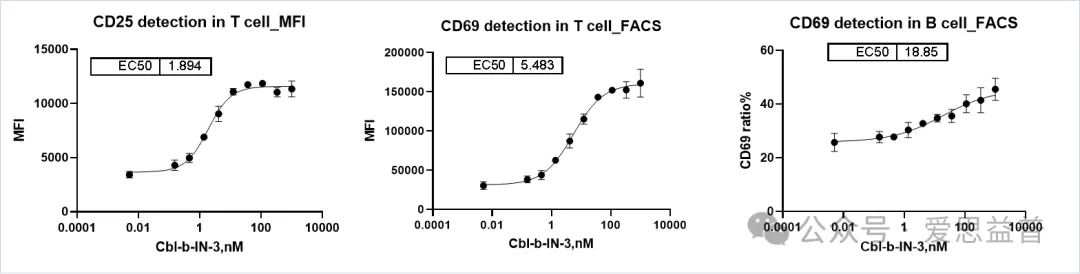
图10. T/B细胞表面Marker的检测
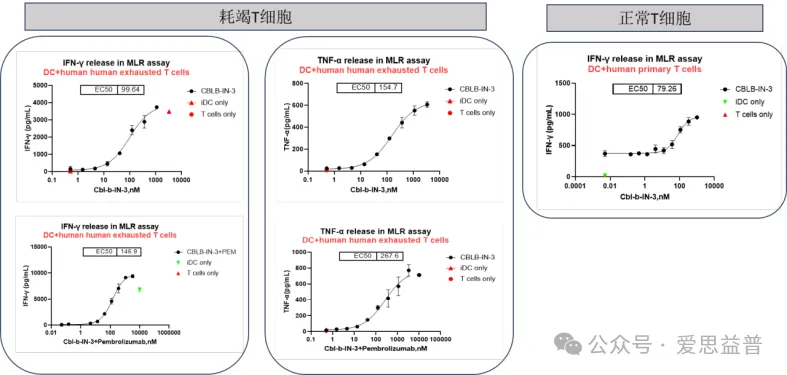
图11. MLR实验

图12. T细胞免疫抑制逆转实验
2.2.2 NK细胞的激活
通过检测化合物处理后NK细胞与K562细胞共培养体系中细胞因子的释放量,来评估化合物对NK细胞的激活效果。
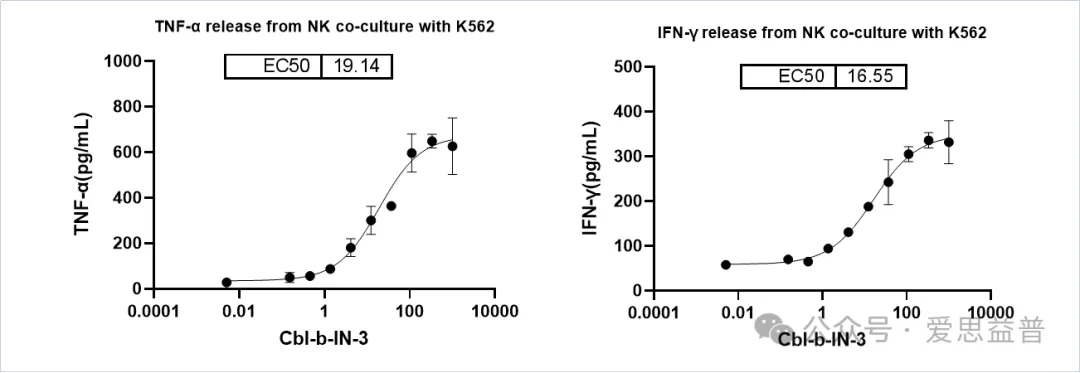
图13. 检测NK细胞激活后TNF-α, IFN-γ的释放
2.2.3 人全血中免疫细胞的激活
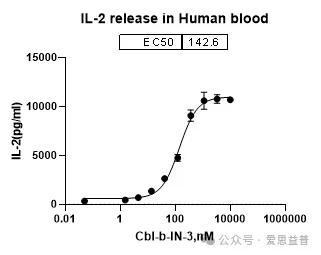
图14.全血中IL-2释放的检测
四、爱思益普细胞生物学团队介绍
爱思益普,拥有人数100+、10年以上丰富经验的细胞学团队。可以提供包括小分子,PROTAC,ADC,抗体药在内的各类药物的检测筛选服务,擅长做各类方法开发及机制探索,合作方式及检测手段灵活多样,紧跟药物研发前沿动态,为客户提供专业高效的各类服务。
肿瘤免疫治疗作为肿瘤治疗的新星,主要通过调控机体自身的免疫系统来实现杀伤肿瘤的目的,具有长期应答、作用持久的特点。以免疫检查点抑制剂为代表的免疫治疗开启了肿瘤治疗新时代。随着对肿瘤免疫相关机制的深入研究,新的激活免疫细胞的方法和药物正在不断被开发。爱思益普团队拥有广泛的科研资源和专业知识,可以为肿瘤免疫药物研发提供有力支持。目前本公司针对肿瘤免疫药物开发建立了完善的体外药物筛选评价平台,包括生化水平的相关测试,细胞水平上用于快速检测的报告基因实验和相应的细胞功能性检测。我们欢迎您垂询,共同探索这一领域的研究机会,为推动科学进步和医学应用贡献力量。
参考文献:
1) Offringa R, Kötzner L, Huck B, Urbahns K. The expanding role for small molecules in immuno-oncology [published online ahead of print, 2022 Aug 18]. Nat Rev Drug Discov. 2022;10.1038/s41573-022-00538-9.
2) Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022;12(1):31-46. doi:10.1158/2159-8290.CD-21-1059.
3) Opitz CA, Somarribas Patterson LF, Mohapatra SR, et al. The therapeutic potential of targeting tryptophan catabolism in cancer. Br J Cancer. 2020;122(1):30-44. doi:10.1038/s41416-019-0664-6.
4) Baumgartner, C.K., Ebrahimi-Nik, H., Iracheta-Vellve, A. et al. The PTPN2/PTPN1 inhibitor ABBV-CLS-484 unleashes potent anti-tumour immunity. Nature 2023, 622 (7984), 850–862.
5) Augustin RC, Bao R,Luke JJ. Targeting Cbl-b in cancer immunotherapy. Journal for ImmunoTherapy of Cancer 2023;11:e006007. doi:10.1136/jitc-2022-006007.