News Detail
 来源:2024-09-14 15:15:19
来源:2024-09-14 15:15:19
 浏览量:22706
浏览量:22706

一、GP2d模型精准助力难成药靶点KRAS G12D临床前药效研究
在人类癌症中,KRAS基因突变出现在接近90%的胰腺癌、30-40%的结肠癌、17%的子宫内膜癌和15-20%的肺癌 (大多为NSCLC) 中。此外,KRAS基因突变还会出现在胆管癌、宫颈癌、膀胱癌、肝癌和乳腺癌等癌症中[1]。
研究发现,KRAS突变位置主要是4个热点密码子 (12、13、61和146)。密码子12是所有4个热点密码子中突变频率最高的,其中G12D突变最常见,其次是G12V、G12C等。根据不同的癌症类型,G12D突变占KRAS突变癌症的20-50%[2]。因此KRAS G12D显然是一个确凿的癌症靶点。
然而,与KRAS G12C不同,KRAS G12D缺乏靠近开关II结合袋的活性残基(使蛋白质能够进行共价修饰)。因此,需要新的方法来开发具有高亲和力、有药物效力的选择性抑制剂。目前已有一些药物处于临床前和初步的临床评估阶段。
GP2d细胞来源于一名71岁女性手术切除时杜克氏B级低分化结肠癌的局部复发。GP2d细胞含有KRAS基因的正常拷贝和密码子12发生转变的拷贝,对EGF、TGF-α或胰岛素表现出生长反应,细胞数量增加。
GP2d是较为代表性的KRAS G12D突变的人结直肠癌细胞,通过建立GP2d小鼠异种移植物肿瘤模型可以评价各药物的体内治疗效果。
二、爱思益普GP2d药效模型
目前爱思益普对于肿瘤药效模型有成熟的细胞质量监测,用于评估细胞和模型质量。
Database展示:
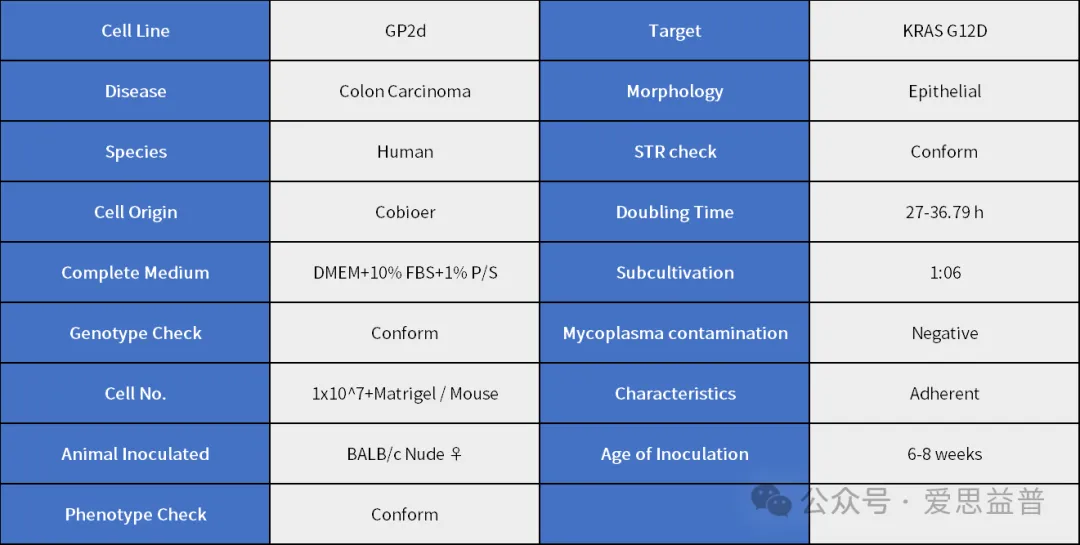
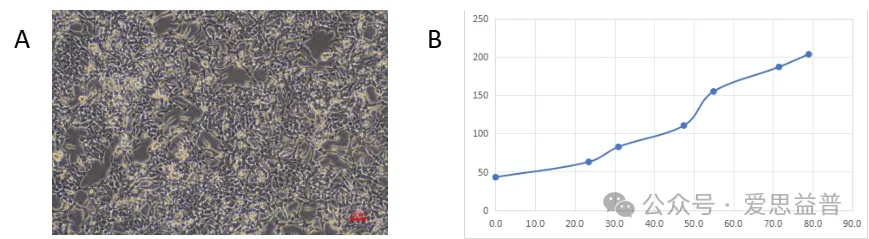
图1:GP2d体外数据:A. 接种前GP2d细胞照片;B. GP2d细胞倍增时间曲线。
在携带KRAS G12D突变的GP2d异种移植小鼠模型中,我们设立阳药组 (Positive Control-3 mpk),通过肿瘤体积变化、小鼠体重变化和瘤重等,计算TGI (%)、T/C (%) 和RTV等结果,结果为Positive Control (3 mg/kg) 能够显现出一定的抗肿瘤活性。
目前爱思益普使用GP2d模型已为药企及科研单位提供服务,为客户提供良好稳定的模型数据。
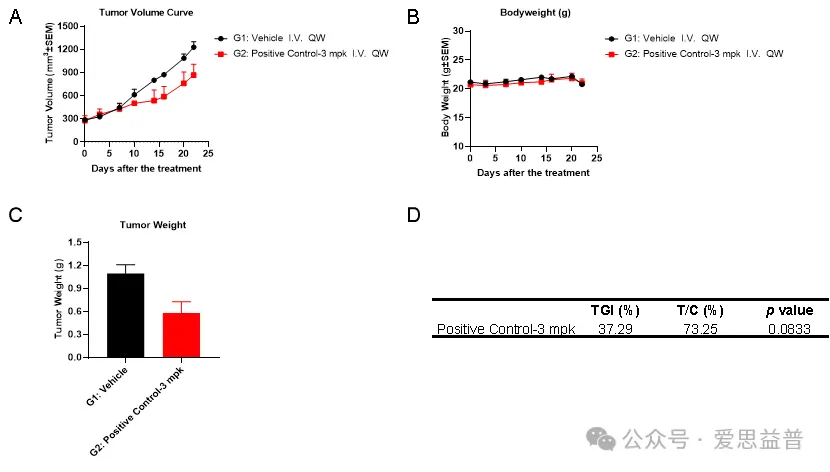
图2:GP2d体内数据:A. 给药测试后的肿瘤体积变化情况;B. 给药测试后的体重变化情况;C. 取材后瘤重数据;D. TGI (%) 、T/C (%) 和p值。
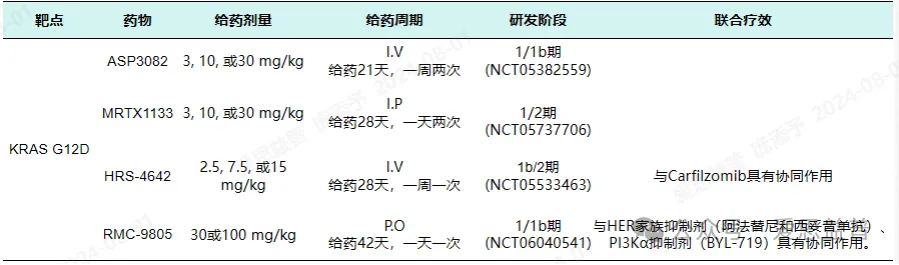
目前,ASP3082是目前唯一一款进入临床阶段的KRAS G12D降解剂,可以认为安斯泰来在KRAS G12D靶向药物的竞逐中占据了速度优势。然而ASP3082仍然需要通过静脉给药[3]。Mirati Therapeutics开发的KRAS G12D选择性非共价KRAS G12D抑制剂MRTX1133则可以通过口服给药,目前处于1/2期临床,在提高患者依从性上更有优势[4]。另外,恒瑞医药也开发了一款注射给药的KRAS G12D靶向药物HRS-4642,已开展临床研究[5]。除此之外,使用RMC-9805对患者进行给药,是Revolution Medicines的一项重大里程碑[6]。口服共价突变选择性KRAS抑制剂RMC-9805首次用于KRAS G12D突变实体瘤患者,这标志着1/1b期临床试验的开始。目前I期研究正在开展中,有望进一步拓展KRAS的药研市场,获益广大患者。
表1:KRAS G12D靶向药物参考数据
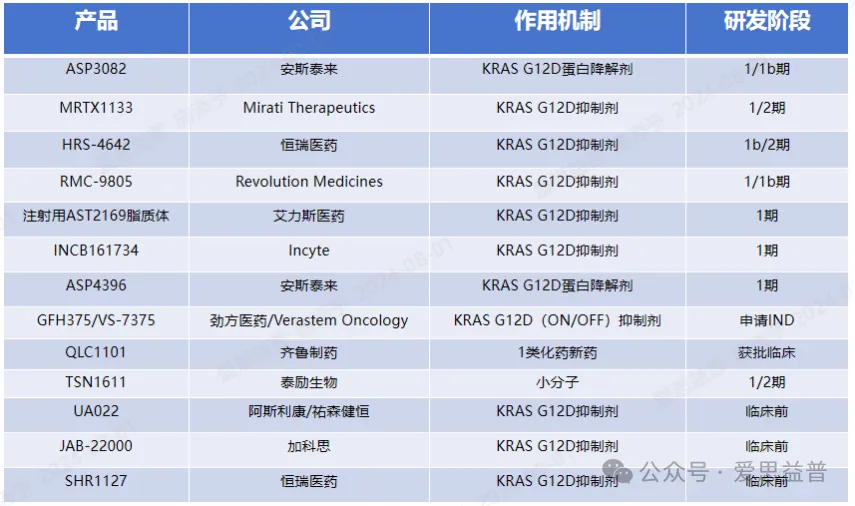
目前全球药企已研发出多款KRAS G12D抑制剂 (表2)。这些在研KRAS G12D抑制剂大多处于早期临床,药物类型除了小分子化药,还涉及降解剂,因此给药方式有所不同,包括静脉给药、口服给药[7]。
表2:全球药企在研KRAS G12D靶向药物及研发阶段
目前看来,KRAS G12D抑制剂进展较慢,但已一定进展,已从“不可成药”实现“成药”。但新药研发失败风险非常高,能否通过临床试验、监管批准顺利上市,KRAS G12D抑制剂仍需进一步开发。我国药企在KRAS G12D抑制剂领域也积极布局,虽较国外慢些,但也有实现弯道超车的可能。期待KRAS G12D抑制剂领域早日实现重大突破。
参考文献
1. Liu P, Wang Y, Li X. Targeting the untargetable KRAS in cancer therapy. Acta Pharm Sin B. 2019 Sep;9(5):871-879. doi: 10.1016/j.apsb.2019.03.002. Epub 2019 Mar 6. PMID: 31649840; PMCID: PMC6804475.
2. Kirschner T, Müller MP, Rauh D. Targeting KRAS Diversity: Covalent Modulation of G12X and Beyond in Cancer Therapy. J Med Chem. 2024 Apr 25;67(8):6044-6051. doi: 10.1021/acs.jmedchem.3c02403. Epub 2024 Apr 15. PMID: 38621359.
3. Nagashima T,et al.Novel KRAS G12D degrader ASP3082 demonstrates in vivo, dose-dependent KRAS degradation, KRAS pathway inhibition, and antitumor efficacy in multiple KRAS G12D-mutated cancer models[J]. Cancer Research,2023,83(7_Supplement): 5735-5735.
4. Wang X, Allen S, Blake JF, Bowcut V, Briere DM, Calinisan A, Dahlke JR, Fell JB, Fischer JP, Gunn RJ, Hallin J, Laguer J, Lawson JD, Medwid J, Newhouse B, Nguyen P, O'Leary JM, Olson P, Pajk S, Rahbaek L, Rodriguez M, Smith CR, Tang TP, Thomas NC, Vanderpool D, Vigers GP, Christensen JG, Marx MA. Identification of MRTX1133, a Noncovalent, Potent, and Selective KRASG12D Inhibitor. J Med Chem. 2022 Feb 24;65(4):3123-3133. doi: 10.1021/acs.jmedchem.1c01688. Epub 2021 Dec 10. PMID: 34889605.
5. Zhou C, Li C, Luo L, Li X, Jia K, He N, Mao S, Wang W, Shao C, Liu X, Huang K, Yu Y, Cai X, Chen Y, Dai Z, Li W, Yu J, Li J, Shen F, Wang Z, He F, Sun X, Mao R, Shi W, Zhang J, Jiang T, Zhang Z, Li F, Ren S. Anti-tumor efficacy of HRS-4642 and its potential combination with proteasome inhibition in KRAS G12D-mutant cancer. Cancer Cell. 2024 Jul 8;42(7):1286-1300.e8. doi: 10.1016/j.ccell.2024.06.001. Epub 2024 Jun 27. PMID: 38942026.
6. Lingyan Jiang, et al; Abstract 526: RMC-9805, a first-in-class, mutant-selective, covalent and oral KRASG12D(ON) inhibitor that induces apoptosis and drives tumor regression in preclinical models of KRASG12D cancers. Cancer Res 1 April 2023; 83 (7_Supplement): 526.
7. Li X, Shen F, Zhang L, et al. Discovery of SHR1127, an orally bioavailable, highly potent and selective KRAS G12D inhibitor[J]. Cancer Research, 2024 AACR. 7279 /16.


扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



