信号转导和转录激活因子(STAT)最初作为DNA结合蛋白被发现,可介导干扰素依赖性基因表达。哺乳动物STAT家族包括STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6,它们介导多种细胞内信号通路。其中,STAT3参与了细胞的增殖、存活、分化和血管生成等多种生物学过程。在正常细胞中,STAT3的瞬时激活(主要是通过磷酸化)将质膜上的细胞因子和生长因子受体的转录信号传递到细胞核[1]。然而,STAT3在大多数人类癌症中变得过度激活,通常与不良的临床预后有关。作为一个转录因子,STAT3调控一系列与癌细胞生存、增殖、血管生成、侵袭、转移、耐药性和免疫逃避有关的基因[2]。因此,靶向 STAT3 信号通路已成为许多癌症的有希望的治疗策略。本文系统的讨论了STAT3相关通路及其抑制剂、降解剂研究进展。
STAT3结构域及信号通路
STAT3是一个由770个氨基酸组成的蛋白质,具有6个功能保守结构域:
1)氨基末端结构域(NTD),用于STAT蛋白与多个共同DNA位点的协同结合;
2)螺旋卷曲结构域(CCD),用于向受体募集STAT3以及随后的磷酸化、二聚化和核转位;
3)DNA结合结构域(DBD),用于识别和结合特定的共同DNA序列;
4)连接结构域(Linker),用于连接DBD和SH2;
5)SRC同源2结构域(SH2),用于募集和激活STAT3分子,通过与相对亚基中的磷酸化酪氨酸残基相互作用来实现STAT3分子的二聚化;
6)羧基末端反式激活结构域(TAD)。如图1所示。在STAT3结构域中,SH2是高度保守的STAT结构域,其通过与特定的磷酸酪氨酸基序结合,在信号转导中起着至关重要的作用[3]。
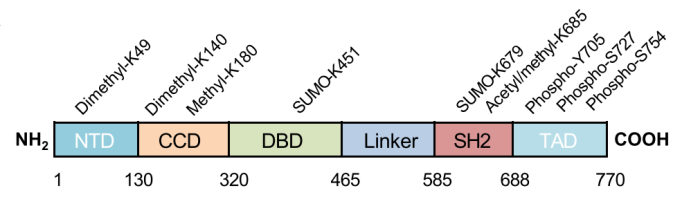
图1 STAT3结构域示意图[4]
在未受刺激的细胞中,STAT3受到负调节因子的严格调控,包括活化STAT蛋白抑制剂(PIAS)、细胞因子信号转导抑制因子(SOCS)家族、蛋白酪氨酸磷酸酶(SHP1、SHP2、PTPN1、PTPN2PTPRD、PTPRT和dusp22)和泛素酶[5],以维持细胞质中的不活跃状态。STAT3是通过几种细胞因子激活的,包括白介素6(IL-6)和白介素10(IL-10),以及生长因子[6-7](如表皮生长因子(EGF)、成纤维细胞生长因子(FGF)和胰岛素样生长因子(IGF))。一旦这些因子与其相应的受体结合,Janus激酶(JAK)就会被激活[8]。STAT3通过2个单体之间的相互SH2结构域-磷酸酪氨酸相互作用形成同源二聚体,并转移到细胞核中,从而在细胞质和细胞核之间交换信号,来介导免疫抑制、血管生成、转移、增殖和生存的信号通路。当pSTAT3移位到细胞核中时,它与包括p68在内的一些共激活因子形成一个复合体,并结合到靶基因的启动子区域来激活它们的转录[9]。图2为肿瘤细胞中经典的IL-6/STAT3信号通路。IL-6与膜结合的IL-6受体α(IL-6R)和IL-6受体β(也称为gp130)结合。IL-6/IL-6R/gp130复合体激活JAKs的磷酸化,继而激活STAT3。其他生长因子如成纤维细胞生长因子(FGF)、胰岛素样生长因子(IGF)和表皮生长因子(EGF)也可以通过与其同源膜受体结合而使STAT3磷酸化。然后,磷酸化的STAT3形成同源二聚体,并移位到核内,与靶基因的启动子区域结合,激活靶基因转录[10]。
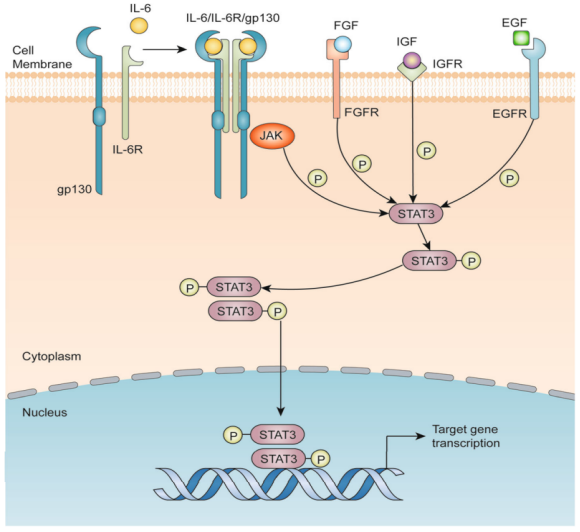
图2 IL-6/STAT3信号通路[11]除磷酸化外,其他翻译后修饰如乙酰化、甲基化、泛素化、SUMO化和谷胱甘肽化,都与STAT3转录活性、二聚化、核易位、与核共激活因子的复合物形成和降解有关,从而为癌症中STAT3的过度磷酸化增加了另一层复杂性。
STAT3可在多种人类肿瘤中被激活,在多种患者来源的肿瘤组织样本中观察到STAT3过表达。大量的累积证据有力地支持使用抑制剂或敲除系统阻断STAT3激活可以作为癌症和其他人类疾病的有吸引力的治疗靶点[12]。STAT3抑制剂的抗肿瘤机制主要有两种:一是阻断STAT3上游通路。二是直接作用STAT3蛋白本身。
抑制STAT3激活的一个有效策略是抑制上游组分,主要集中在抑制JAK、Src和受体酪氨酸激酶(RTK)方面。JAK是STAT3最重要的上游信号因子,在某些应激反应条件下,一些细胞因子与相应的受体结合,诱导JAK磷酸化,从而使STAT3活化。Src是一种与细胞膜相关的非受体酪氨酸激酶,在肿瘤细胞的增殖、迁移和分化过程中发挥关键作用。在分子水平上,Src诱导酪氨酸残基磷酸化从而使STAT3活化。RTK
可与一些受体结合,使自身发生磷酸化,从而诱导STAT3激活。RTK的受体包括表皮生长因子受体(EGFR)、成纤维细胞生长因子受体(FGFR)、人类表皮生长因子受体2(HER2)、肝细胞生长因子受体(HGFR)、血小板衍生生长因子受体(PDGFR)、血管生长因子受体(VEGFR)和胰岛素样生长因子受体(IGFR)等[13]。因此,STAT3的间接抑制剂与这些组分相互作用,抑制 STAT3 的激活,进而导致STAT3调控基因表达失败。
 来源:本站
来源:本站
 浏览量:18966
浏览量:18966








