News Detail
 来源:本站
来源:本站
 浏览量:21459
浏览量:21459
爱思益普,拥有人数100+、10年以上丰富经验的细胞生物学团队,可以提供包括小分子、PROTAC、ADC及抗体药物在内的各类药物的检测筛选服务,精于细胞生物学各种方法开发和探索实验,紧跟药物研发前沿动态,检测手段多样,合作方式灵活,可为工业及科研用户提供专业高效的筛选及检测服务。
癌症靶向治疗旨在靶向与癌症相关的生物分子(如癌蛋白),并干扰其在癌症组织中的致癌细胞过程。在过去的几十年里,靶向治疗在癌症方面取得了显著的进展,成为癌症患者有力的治疗策略。例如,小分子抑制剂或单克隆抗体已被成功开发用于靶向癌症中过表达或过激活的蛋白。然而,由于这些靶向治疗的疗效、耐药性和脱靶效应有限,研究人员仍在寻求更有效和特异性的策略来靶向癌症相关的癌蛋白。
受细胞利用泛素-蛋白酶体系统(UPS)维持细胞内蛋白质这一事实的启发,2001年,Dehaies设计并合成了功能分子Protac-1,通过招募UPS诱导蛋氨酸氨肽酶-2 (MetAP-2)的降解。Protac-1由三个共价连接的片段组成:一个含有被Skp1-Cullin-F-box复合物识别的IκBα磷酸肽的结构域(SCF,一种通过UPS启动蛋白质泛素化和降解的E3连接酶),一个含有卵清素的结构域(MetAP-2抑制剂),以及一个连接这两个结构域的接头结构。这项工作提出了蛋白降解靶向嵌合体(PROTAC)的初始概念,这是一种通过UPS在活细胞中诱导目的蛋白(POI)降解的工程化技术。Protac-1作为METAP2和β-TRCP之间的纽带,使连接酶能够使未受精非洲爪蟾卵提取物中的METAP2泛素化并降解。
随后,缺氧诱导因子1亚单位-α (HIF1α)的肽结合E3连接酶von Hippel-Lindau肿瘤抑制因子(VHL)的发现导致了细胞穿透PROTAC的设计,该PROTAC可降解一系列POI。HIF1α肽的小分子模拟物的发现为基于小分子结构的PROTAC的合理设计打开了大门1。例如,第一个基于溴结构域蛋白抑制剂JQ1的PROTAC招募VHL来降解含溴结构域蛋白4 (BRD4)。
在早期PROTAC分子开发的同时,E3连接酶cereblon(CRBN)被确定为沙利度胺及其类似物来那度胺和泊马度胺的靶标,这些药物在癌症治疗中被称为免疫调节亚胺药物(IMiDs),利用CRBN靶向IKAROS家族锌指1 (IKZF1)和IKZF3降解。此外,磺胺类药物是一种用于治疗某些实体肿瘤和白血病的小分子细胞周期抑制剂,通过促进E3连接酶损伤特异性DNA损伤结合蛋白1 (DDB1)和CUL4相关因子15 (DCAF15)以及pre-mRNA剪接因子RNA结合基序蛋白 (RBM39)和相关剪接因子RBM23之间的相互作用,显示出类似的功能。AR降解剂ARV-110在重度预处理的转移性去势抵抗性前列腺癌(mCRPC)患者中进行了药效评估2。初步试验数据显示,ARV-110在高达420 mg的剂量下具有良好的耐受性,肿瘤中ARV -110介导靶蛋白降解。ARV110已经进入II期临床试验。ARV-471作为ER+/HER2-局部晚期或转移性乳腺癌患者的单药治疗进入II期临床试验3。ARV-471的中期数据显示其耐受性可控,具有强大的临床疗效信号,在大量预处理人群中有42%的临床获益率。

图1 PROTAC技术发展历史4
UPS是真核细胞中降解正常和错误折叠蛋白质的高度保守机制,从而保持细胞内蛋白质稳态5。在UPS中,待降解的蛋白质用泛素(Ub,一种76个氨基酸的蛋白质)共价标记,这一标记过程由三种酶催化,即Ub活化酶(E1)、Ub结合酶(E2)和Ub连接酶(E3):游离Ub被E1激活,然后通过ATP依赖反应与E1的半胱氨酸残基(Cys)连接形成硫酯键;Ub标记的E1通过反式硫代酯化反应将其Ub转移至E2的Cys,形成Ub-E2复合物。最后,E3连接酶促进了相应的Ub-E2偶联物与底物蛋白的接近,从而将泛素标记为底物蛋白的赖氨酸残基。经过酶级联反应的若干循环,标记有多个泛素残基的蛋白质被蛋白酶体识别和降解。降解后,泛素蛋白被去除并循环利用。人类蛋白质组中有两个E1,约40个E2和600多个E3。其中,E3连接酶负责特异性识别底物6。PROTAC可以利用UPS机制通过靶向级联反应的第三步来降解特定的靶蛋白。受UPS的启发,研究人员设计了PROTAC来“挟持”UPS并降解POI7。PROTAC分子由三个共价结合部分组成:一个配体结合POI (POI配体),另一个配体识别E3连接酶(E3配体)和一个接头负责共轭连接两个配体。PROTAC同时招募E3连接酶和POI,形成“E3-PROTAC-POI”三元复合物,从而促进Ub转移到靶蛋白上。PROTAC扮演催化剂的作用,直到它被代谢和清除8。
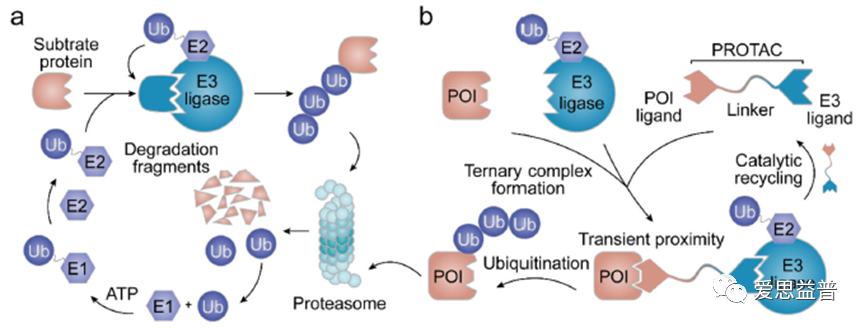
图2 泛素-蛋白酶体系统(a)和PROTAC介导的蛋白质降解(b)的作用机制示意图9
由于其独特的作用机制和小分子结构,与核酸或蛋白质衍生的小分子抑制剂和其他治疗药物相比,PROTAC具有以下优势:
(1)PROTAC通过转录后调控发挥作用,对基因组和转录组的影响可以忽略不计;
(2) PROTAC是可回收的,可参与多轮泛素化;
(3) PROTAC通过E3连接酶和POI的短暂接近诱导蛋白质降解,而不是小分子抑制剂的紧密结合驱动模型;
(4)由于E3连接酶和POI之间的特异性结合,PROTAC实现了目标特异性;
(5) PROTAC具有模块化结构,可用于靶向多种蛋白质。
这些独特的性质使得PROTAC可以在低浓度下诱导功能丧失,并且它们具有靶向历史上被认为是“不可成药”的蛋白质并克服耐药性的潜力。
癌症的发生和发展是一个复杂的过程,其特征是维持增殖信号,逃避生长抑制因子,抵抗细胞死亡,诱导血管生成,激活侵袭和转移。证据表明,一些过度表达和/或过度活化的蛋白在肿瘤发生中起着关键作用,并可作为潜在的治疗靶点10。
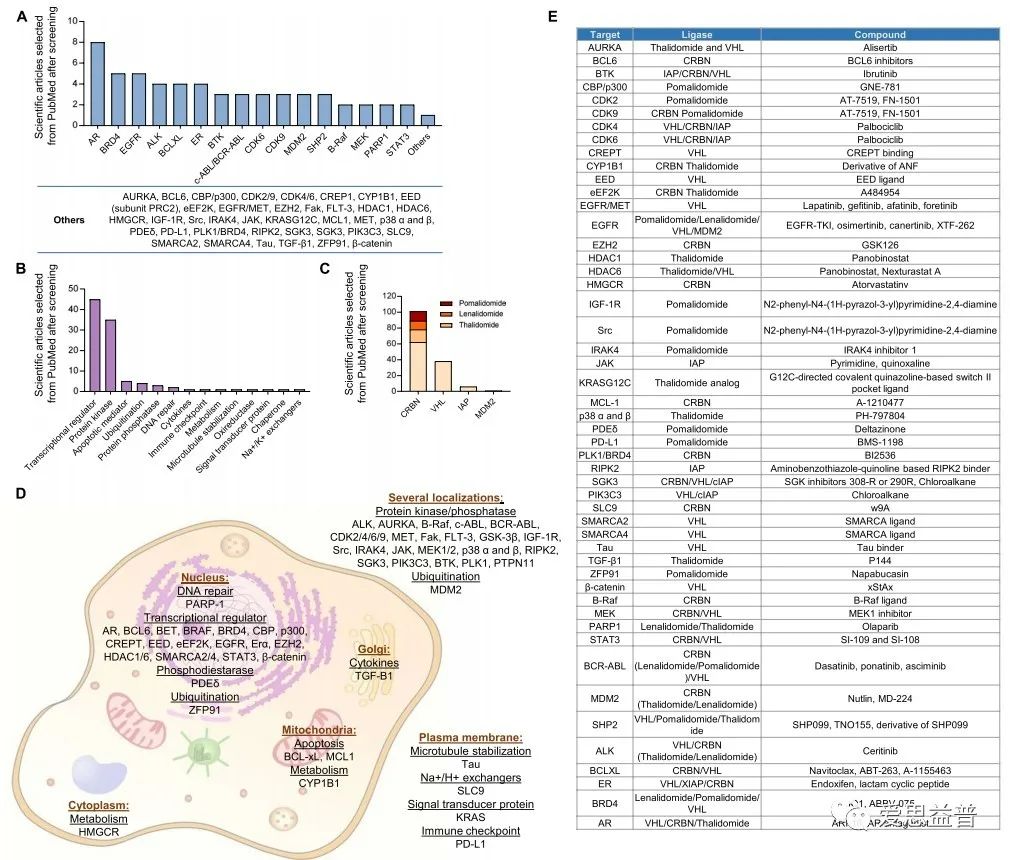
图3 癌症治疗中PROTAC相关靶点11
爱思益普PROTAC药物筛选平台提供完整的PROTAC评价体系,打造了集蛋白表达、三元复合物形成、蛋白质降解、细胞增殖、细胞信号通路调节评价、HiBiT敲入细胞系构建、敲除细胞系构建等相关检测平台,拥有稳定的生物物理学、酶学和细胞学检测体系,旨在助力新药发现,促进新药研发进程。
爱思益普提供多种PROTAC相关靶点重组蛋白,各批次蛋白均经过纯度和活性验证,充分满足各种实验需求。
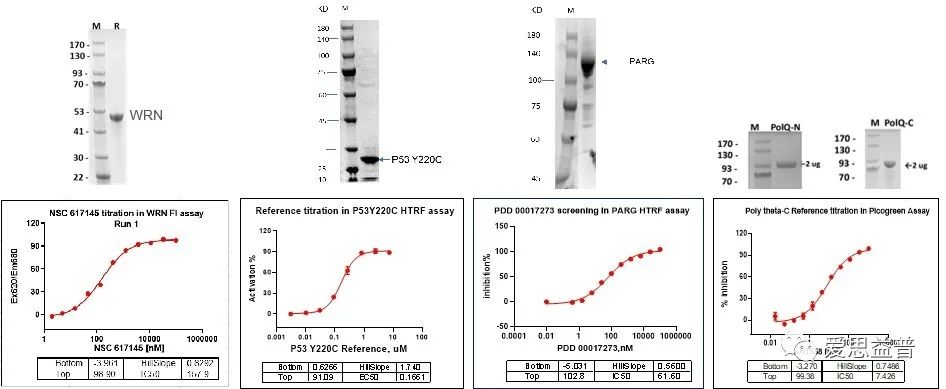
图4 爱思益普蛋白表达平台展示-WRN, P53 Y220C, PARG, POLQ
PROTAC与目标蛋白和E3连接酶形成三元复合物,是下游泛素化反应所必需的前体。爱思益普拥有多项技术平台,可用于测试三元复合物的形成,包括TR-FRET、BRET、FP、AlphaLISA等。
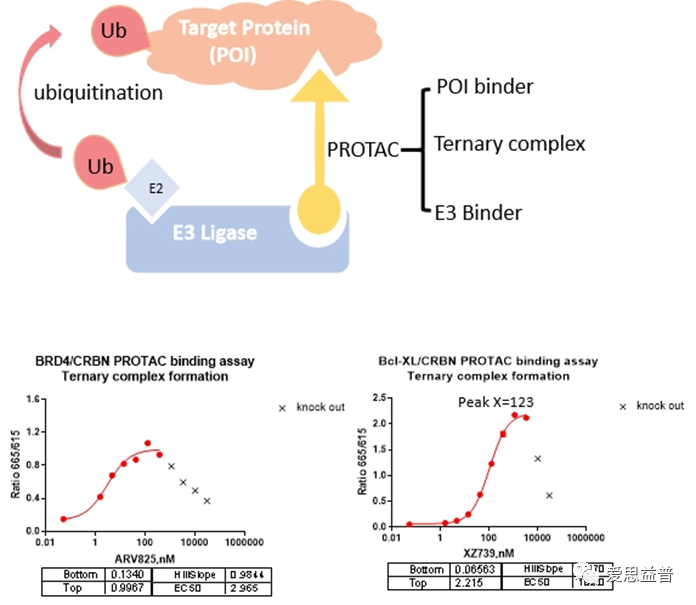
图5 PROTAC三元复合物形成检测数据
蛋白质降解是PROTAC分子活性评价的重要指标。爱思益普提供多种蛋白质降解评价技术平台,包括传统Western blot、基于毛细管电泳技术的Digital Western Blot (JESS)、高通量IFA、In-cell WB (ICW)、 ELISA、AlphaLISA、HTRF等,使用不同方法检测PROTAC化合物的蛋白降解能力,提供可靠的DC50和Dmax。
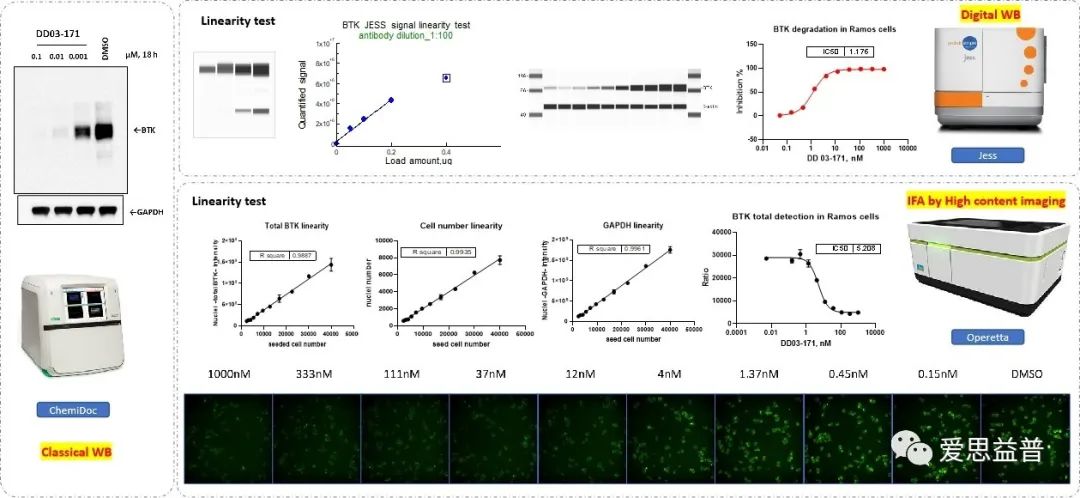
图6 蛋白降解的检测传统WB(化学发光&荧光)、数字WB(JESS)、高通量免疫荧光分析(IFA)、胞内蛋白印迹检测(In-cell WB, ICW)
癌细胞的特征之一是可以生成内源性的促增殖信号,不依赖于外源性刺激,例如NF-κB、PI3K/AKT、MAPK、JAK-STAT、TGF-β、Wnt、Notch、Hedgehog和Hippo等通路的持续活化。爱思益普在PROTAC靶点检测方面积累了丰富的经验,可针对多个通路开展蛋白降解及相关信号通路标志物的检测。

图7 爱思益普已经建立好的不分PROTAC降解筛选靶点展示
爱思益普通过CRISPR基因编辑技术在基因组水平上敲入HiBiT萤光素酶小标签,使用多种方法在基因和蛋白水平上验证内源性目标蛋白的正确标记,建立可用于高通量筛选的稳定HiBiT细胞系,实现对PROTAC分子靶蛋白降解水平的定量检测。
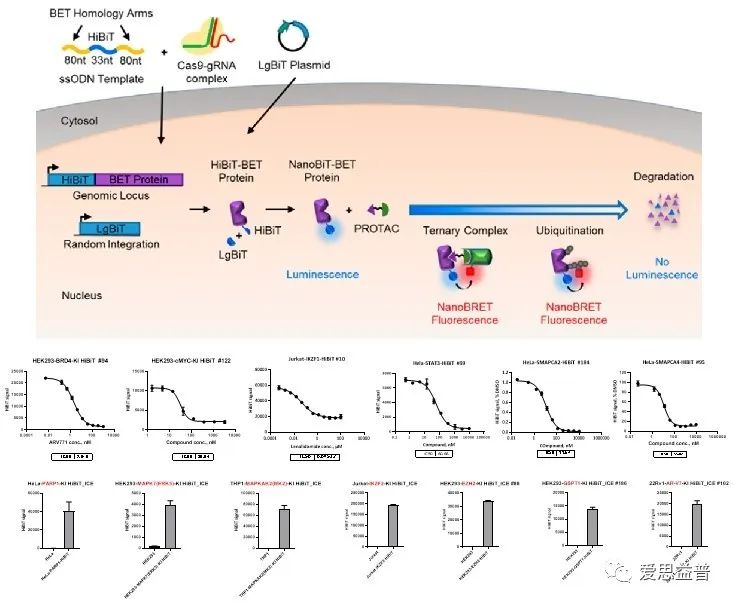
图8 HiBiT敲入细胞系构建原理和数据展示
利用各种基因编辑技术,爱思益普在基因组水平上敲除PROTAC相关分子(如靶蛋白,相关E3连接酶),使用多种方法在基因和蛋白水平上验证内源性目标蛋白的正确敲除,建立适合高通量筛选的敲除细胞系,实现对PROTAC分子的相关评价。
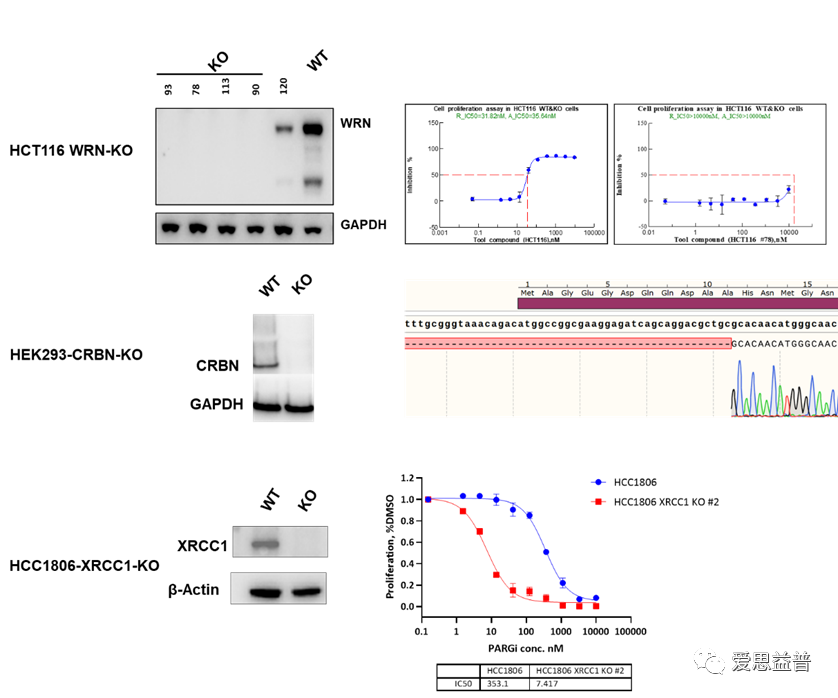
图9 部分敲除细胞系的展示
爱思益普团队不仅可以提供针对PROTAC药物的体外评价体系,同时具有相关DMPK的性质分析、体内动物模型的药效评价以及神经心脏安全和体外次级药理学安全性评价(Safety panel)等服务经验,对PROTAC相关服务感兴趣的同仁,欢迎随时联系我们索取资料!
1. Kelm, J. M. et al. PROTAC'ing oncoproteins: targeted protein degradation for cancer therapy. Mol Cancer 22, 62, doi:10.1186/s12943-022-01707-5 (2023).
2. He, M. et al. PROTACs: great opportunities for academia and industry (an update from 2020 to 2021). Signal Transduct Target Ther 7, 181, doi:10.1038/s41392-022-00999-9 (2022).
3. Bekes, M., Langley, D. R. & Crews, C. M. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov 21, 181-200, doi:10.1038/s41573-021-00371-6 (2022).
4. Zhao, L., Zhao, J., Zhong, K., Tong, A. & Jia, D. Targeted protein degradation: mechanisms, strategies and application. Signal Transduct Target Ther 7, 113, doi:10.1038/s41392-022-00966-4 (2022).
5. Burslem, G. M. & Crews, C. M. Proteolysis-Targeting Chimeras as Therapeutics and Tools for Biological Discovery. Cell 181, 102-114, doi:10.1016/j.cell.2019.11.031 (2020).
6. Chirnomas, D., Hornberger, K. R. & Crews, C. M. Protein degraders enter the clinic - a new approach to cancer therapy. Nat Rev Clin Oncol 20, 265-278, doi:10.1038/s41571-023-00736-3 (2023).
7. Li, X. et al. Proteolysis-targeting chimeras (PROTACs) in cancer therapy. Mol Cancer21, 99, doi:10.1186/s12943-021-01434-3 (2022).
8. Dale, B. et al. Advancing targeted protein degradation for cancer therapy. Nat Rev Cancer 21, 638-654, doi:10.1038/s41568-021-00365-x (2021).
9. Chen, Y. et al. Proteolysis-targeting chimera (PROTAC) delivery system: advancing protein degraders towards clinical translation. Chem Soc Rev 51, 5330-5350, doi:10.1039/d1cs00762a (2022).
10. Choudhary, D. et al. Target protein degradation by protacs: A budding cancer treatment strategy. Pharmacol Ther 250, 108525, doi:10.1016/j.pharmthera.2023.108525 (2023).
11. Nieto-Jimenez, C., Morafraile, E. C., Alonso-Moreno, C. & Ocana, A. Clinical considerations for the design of PROTACs in cancer. Mol Cancer 21, 67, doi:10.1186/s12943-022-01535-7 (2022).