News Detail
 来源:本站
来源:本站
 浏览量:12318
浏览量:12318
STK33激酶表达
人类基因组编码大约538种蛋白激酶,蛋白激酶能催化蛋白质磷酸化反应,进而维持蛋白质活性,在细胞增殖、分化、代谢及凋亡等一系列生理过程中发挥重要作用,而蛋白激酶的突变或者过度表达常常与肿瘤的发生发展密不可分。丝氨酸/苏氨酸激酶(serine/threonine kinase,STK)是一大类能够特异性磷酸化丝氨酸/苏氨酸残基的重要激酶家族,STK33是近年来被报道的丝氨酸/苏氨酸激酶的热点成员。
国外学者在2001年首次报道了STK33 基因,其位于基因丰富的人类染色体11p15. 3 区域及小鼠的7号染色体上,包含12个外显子,开放阅读框片段长1545 bp,编码分子质量为5. 783 × 104 的蛋白质。STK33在人体中的表达不具有普遍性,且在大多数组织中表达水平较低,胎儿肺、心、脊髓和脑中可检测到 STK33 表达。据报道,STK33在表达模式上与钙离子/钙调蛋白依赖性蛋白激酶Ⅰ(calcium/ calmodulin-dependent protein kinase Ⅰ,CAMK Ⅰ)高度相似,可被钙离子/钙调蛋白激活,而丝氨酸和苏氨酸存在STK33的自动磷酸化位点,说明STK33很可能与CAMK家族功能相似,通过自动磷酸化保持其激酶活性,参与众多生物学行为,但其如何在众多生物学行为中严格执行调控机制尚不明确。
研究发现,STK33 不仅表达于正常组织中,不同类型的肿瘤中也检测出 STK33的表达。通过高通量 RNA 干扰的方法,在多种组织来源的肿瘤细胞系中发现,依赖Kirsten 鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)突变的 肿瘤细胞均表现出 STK33 的抑制敏感性,提示STK33 的激酶活性或许是影响依赖KRAS突变的肿瘤细胞生存的必要条件,其机制可能是抑制 STK33 降低核糖体蛋白S6激酶 1(ribosomal protein S6 kinase 1,S6K1)的磷酸化,减少线粒体凋亡,进而提高细胞的存活和增殖能力,这被称为与KRAS 之间的“合成致死”效应,而不依赖KRAS突变的细胞未检测出类似的改变。“合成致死”基因的筛选有助于发掘新的肿瘤药物靶点,拓展肿瘤药物研发的思路。
肿瘤一直被视为阻碍人类健康的难以攻克的疾病,靶向治疗是肿瘤研究的热门,探索新的靶点对肿瘤的靶向治疗十分必要。在新药研发初期,无法确定化合物对哪些靶点起作用,进行激酶谱筛选,反向找靶,可快速确认方向。在已经确认方向之后,在判断化合物对其他蛋白激酶有没有抑制率,进行初步的安全性评价至关重要,因此进行一个低浓度大范围体外激酶谱筛选,明晰对哪些激酶靶点有脱靶效应,尤其是同家族激酶,就很有意义。在进行激酶谱筛选之后,进一步调整化合物结构以进行精准中靶,降低脱靶带来的毒副作用。
激酶谱筛选的优势:
l提供激酶谱定制服务
l功能性筛选。
l所有靶点均为人源靶点。
l周周安排检测。
l提供中英文报告,可视化结果展示,全面支持中美IND申报。
l更好的售后服务体验,根据客户投稿要求进行展示图的格式修改。
推出的激酶谱类型:
lCDK激酶谱
lTK酪氨酸激酶谱
l80核心野生型激酶谱
l217野生型激酶谱
l330野生型激酶谱
l416全激酶谱
l定制谱
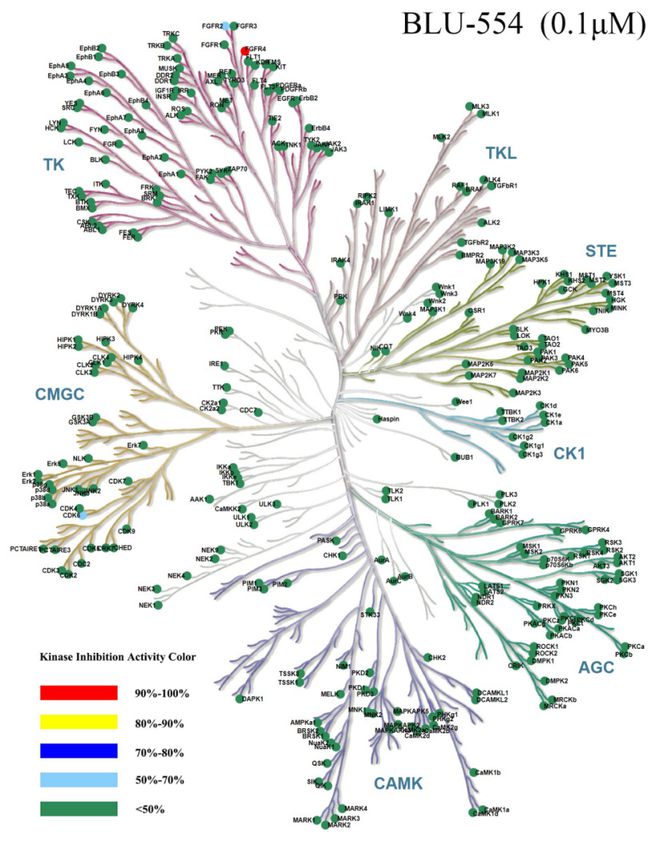
验证数据展示:
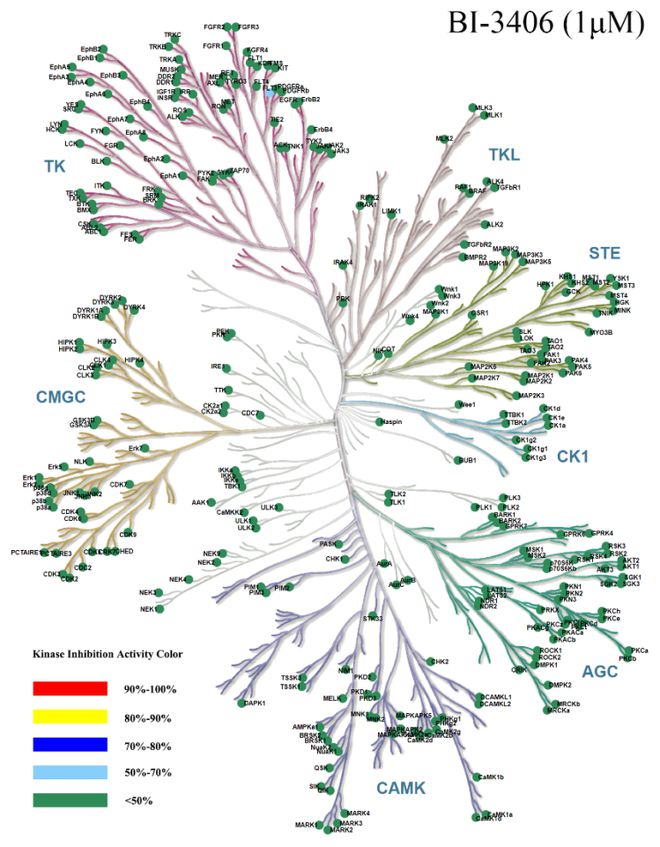
图 Kinase Panel 416激酶谱树图展示

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



