News Detail
 来源:2024-08-29 14:45:20
来源:2024-08-29 14:45:20
 浏览量:19928
浏览量:19928

随着WRN可能是MSI恶性肿瘤的合成致死新靶点的发现,基于靶向MSI恶性肿瘤的WRN抑制剂的研究也引起了科研人员和药物研发人员的兴趣。今年AACR年会上公布了众多癌症治疗最新进展,其中涉及WRN靶点的就有5种药物,再掀起WRN靶点在肿瘤治疗创新药研发的热潮。
1、WRN与MSI之间存在合成致死关系
DNA修复机制组件的缺陷,如BRCA1/2突变或受损的DNA错配修复(MMR),是肿瘤细胞的共同特征,加速了肿瘤生长和转化所需的DNA突变或染色体畸变的积累[1] 。MMR缺乏症是由DNA复制过程中解决核苷酸碱基不匹配问题的DNA修复机制的基因失活引起的。MMR缺陷导致整个基因组中串联核苷酸重复长度的特征性变化,称为微卫星不稳定性(MSI),是一种普遍存在的超突变的病理状态,发生在基因组中的短串联重复DNA序列[2]。MSI可以导致肿瘤细胞基因组进一步紊乱和突变,从而促进恶性肿瘤的发生发展,是公认的重要致癌途径之一。其已经在许多类型的人类癌症中观察到,最常见的是结直肠癌、子宫内膜癌和胃腺癌。具有高水平微卫星不稳定性(MSI-H)的错配修复缺陷(MMRD)肿瘤对免疫治疗往往反应良好,但对传统化疗的反应相对较差[3][5]。此外,只有大约一半的MMRD肿瘤患者对免疫疗法有持久的反应 [6]。因此,迫切需要更多的手段来对抗这些致命的疾病如图1所示。
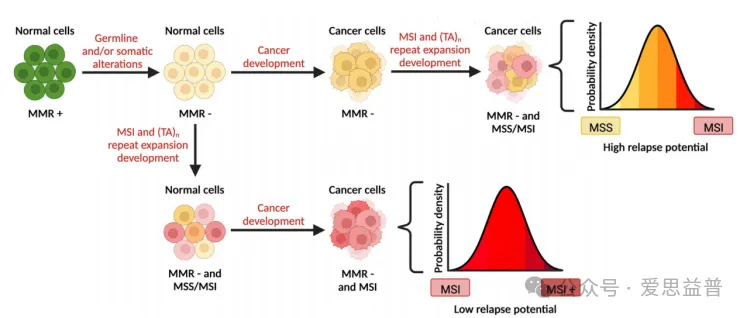
图1:MSI和癌症发展的时间差异可能导致WRN抑制的临床结果对比[4]。
WRN是DNA解旋酶RecQ家族的成员,RecQ解旋酶参与多个DNA加工步骤,包括DNA复制、双链断裂修复、转录和端粒维护,因此被认为是“基因组看护人”[5]。WRN是人类RecQ解旋酶家族中唯一拥有3’→5’核酸外切酶活性的成员。其N末端的核酸外切酶区域有利于WRN处理复杂的核酸结构,中间的解旋结构域能结合并水解ATP,从而供能解开双链DNA。C末端的HRDC结构域可调节催化与DNA结合的活性[6]。
在过去几年中,多项研究已经确定了人类MSI-H癌症对RECQ家族解旋酶WRN的独特依赖性[7, 8]。揭示了自20年前PARP抑制被证明能特异性杀死同源重组缺陷乳腺癌/卵巢癌以来最显著的合成致命性例子之一。相关结果显示,MSI-H细胞在WRN沉默后,细胞发生明显的凋亡,而MSS(微卫星稳定性)细胞未观察到细胞凋亡现象[9]如图2所示。
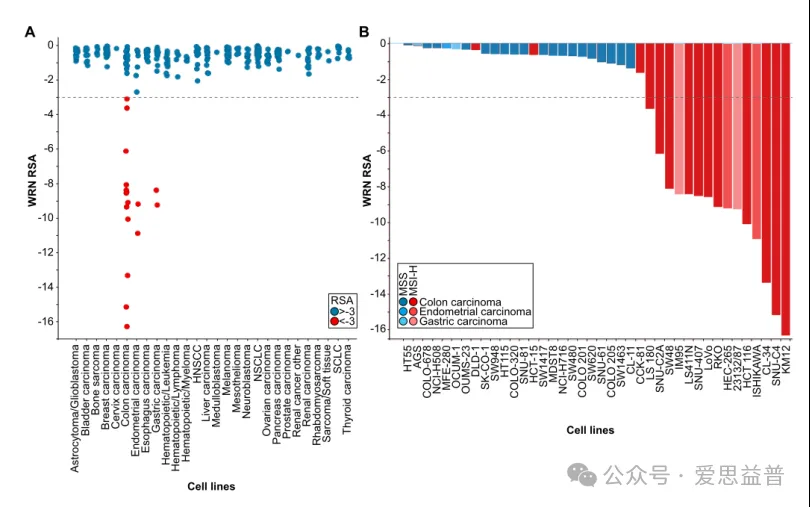
图2:A: Project Drive汇集的shRNA耗尽筛查中的WRN shRNA活性,根据肿瘤类型对细胞系进行分类;
B: Project Drive中结直肠癌、子宫内膜癌和胃癌模型的MSS/MSI-H状态和WRN RSA[6]
2、关于WRN抑制剂的研究
第一个具有抑制活性的是NSC 19630,从国家癌症研究所(NCI)化合物库中筛选出来的,NSC 19630和结构相关的化合物NSC 617145被确定在人类细胞培养实验中具有生物活性,并已被用来探讨WRN在细胞对DNA损伤或复制应激的反应中的作用。
随着WRN可能是MSI恶性肿瘤的合成致死新靶点的发现,导致制药业大力推动开发临床级别的WRN抑制剂。目前已公开的WRN结构抑制剂有4篇,分别来自于IDEAYA和诺华。其中,诺华的HRO-761是WRN抑制剂中研究进度最靠前的药物,目前已进入到临床1期研究阶段,也是目前唯一一款进入临床阶段的WRN抑制剂,在研适应症包括MSI实体瘤、MMRD实体瘤和MSI结直肠癌。去年6月,诺华在clinicaltrials.gov上登记了一项评估HRO-761作为单一药物和与tislelizumab或irinotecan联合使用治疗效果的1期试验,目前仍处于患者招募状态,预计将于2026年8月完成试验。
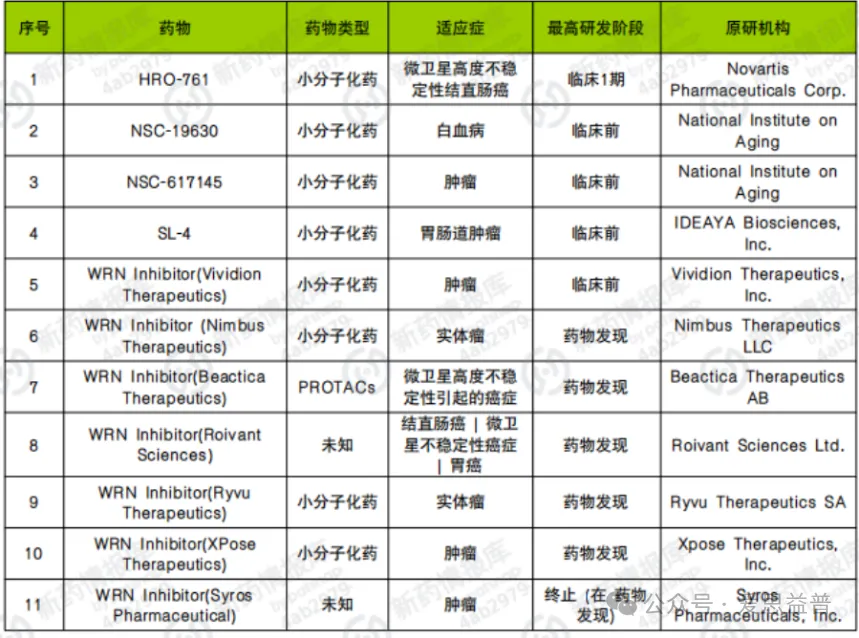
图3:全球WRN抑制剂的基本信息汇总[11]
3、爱思益普在WRN应对MSL恶性肿瘤方法开发的新进展
随着WRN逐渐成为MSI恶性肿瘤的合成致死新靶点的发现,基于靶向MSI恶性肿瘤的WRN抑制剂的研究也引起了科研人员和药物研发人员的兴趣。爱思益普一直追求助力合成致死靶点药物的研发,早期已报道WRN靶点药物筛选在酶学方面的能力。现已有多个模型可验证WRN抑制剂的体内外药效,包括MSS和MSI细胞。我们在不同的细胞上做WRN螺旋酶抑制剂HRO761药效测试,体外IC50结果显示,SNU-407、RKO、HCT116、SW48对HRO761敏感度很高,如图4所示。
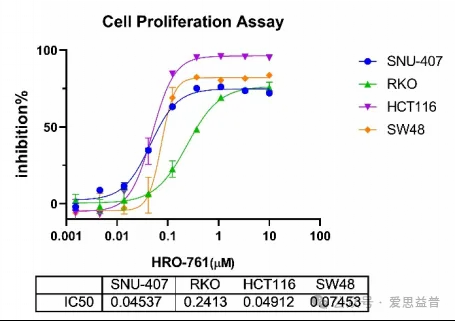
图4:WRN靶点抑制剂对不同细胞的抑制情况。
进一步,我们选取HCT116 CDX 模型在体内对HRO761做药效评估。药效结果也与诺华正在AACR会议上公开的poster结果相吻合。在给药20天之前,处理组肿瘤的抑制效果显著,随着同剂量继续给药,处理组肿瘤逐渐开始增长。整体看处理组的药效结果良好,同时这也对治疗WRN耐药的情况提供一定可行性。为验证该化合物在小鼠体内药物浓度的变化,我们对处理组在实验结束后做伴随PK实验,结果显示化合物代谢8小时后更为明显,除此之外,我们也构建了多个CDX模型,可以支持该靶点的药效筛选,如图5所示。
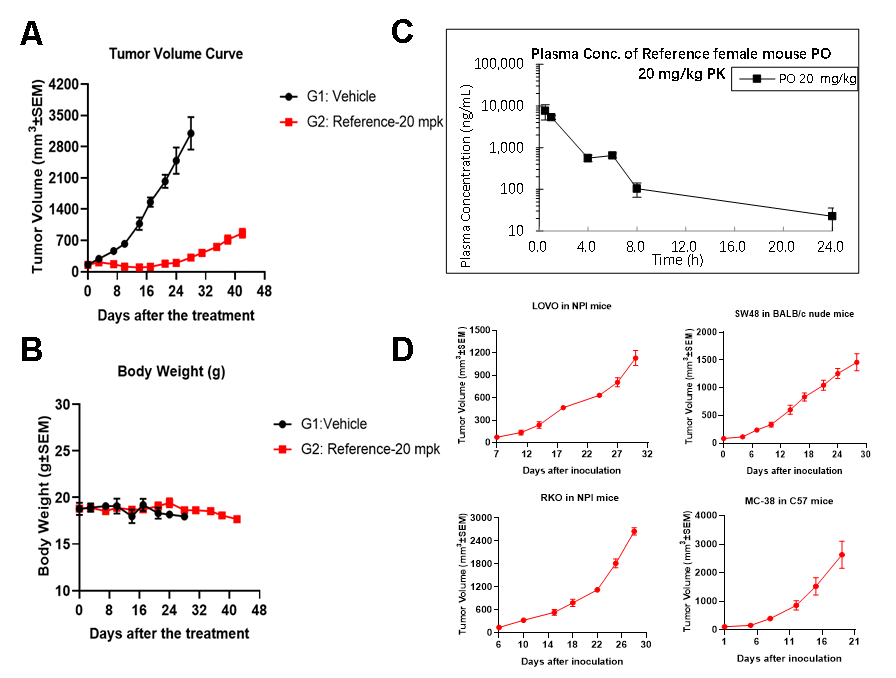
图5:A:WRN抑制剂在HCT116 体内模型处理后肿瘤体积的变化情况, B: WRN抑制剂在HCT116 体内模型处理后小鼠体重的变化情况,
C:化合物在体内代谢检测情况, D: 相关体内模型成瘤曲线。
撰稿人----曲华艺、代海婷
参考文献
1. Kinzler, K.W. and B. Vogelstein, Cancer-susceptibility genes. Gatekeepers and caretakers. Nature, 1997. 386(6627): p. 761, 763.
2. Olave, M.C. and R.P. Graham, Mismatch repair deficiency: The what, how and why it is important. Genes Chromosomes Cancer, 2022. 61(6): p. 314-321.
3. Cervantes, B., T. André, and R. Cohen, Deficient mismatch repair/microsatellite unstable colorectal cancer: therapeutic advances and questions. Ther Adv Med Oncol, 2024. 16: p. 17588359231170473.
4. Morales-Juarez, D.A. and S.P. Jackson, Clinical prospects of WRN inhibition as a treatment for MSI tumours. npj Precision Oncology, 2022. 6(1): p. 85.
5. Croteau, D.L., et al., Human RecQ helicases in DNA repair, recombination, and replication. Annu Rev Biochem, 2014. 83: p. 519-52.
6. Lieb, S., et al., Werner syndrome helicase is a selective vulnerability of microsatellite instability-high tumor cells. Elife, 2019. 8.
7. Picco, G., et al., Werner Helicase Is a Synthetic-Lethal Vulnerability in Mismatch Repair-Deficient Colorectal Cancer Refractory to Targeted Therapies, Chemotherapy, and Immunotherapy. Cancer Discov, 2021. 11(8): p. 1923-1937.
8. Morales-Juarez, D.A. and S.P. Jackson, Clinical prospects of WRN inhibition as a treatment for MSI tumours. NPJ Precis Oncol, 2022. 6(1): p. 85.
9. Zong, D., et al., Comprehensive mapping of cell fates in microsatellite unstable cancer cells supports dual targeting of WRN and ATR. Genes Dev, 2023. 37(19-20): p. 913-928.
10. 智慧芽新药情报库

扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



