News Detail
 来源:2024-03-22 09:24:04
来源:2024-03-22 09:24:04
 浏览量:14425
浏览量:14425
每年的3月21日为世界睡眠日。2024年是世界睡眠日引入我国的第21个主题宣传日,主题为“健康睡眠 人人共享”。
睡眠是维持机体正常功能的重要生理活动,充足、良好的睡眠可以使人恢复精力和体力。随着人们生活节奏加快和工作压力激增,失眠已成为当今社会普遍存在的健康问题。据国内流行病学统计,失眠患病率为15%,其中老年人患病率为35. 9%[1]。失眠问题日益显著,因此研发能够改善睡眠质量的药物已成为当今热点话题。
啮齿类动物是研究失眠最常用的模式动物,但睡眠模式和人类存在差异。从睡眠结构来说,人类睡眠模式多呈单相,而啮齿类动物的睡眠则是多相的。具体来说,人类睡眠包括快速眼动睡眠(rapid eye movement, REM)和非快速眼动睡眠(non-rapid eye movement, NREM)。啮齿类动物睡眠虽然也包括这2个阶段,且REM与NREM交替发生,但其循环周期比人类快得多,每个周期为12 ~20 min,每24 h 125个周期[2]。波形特征也不尽相同: 啮齿类动物REM的脑电图特征为有规律的低振幅θ波节律和低肌电信号; NREM的脑电图振幅较大,以同步δ波活动为主,肌电信号较低; 觉醒的特征是较高和可变的肌电图和低振幅的脑电图,包括较慢的(困倦时的δ)和较快的(探索行为时的θ)成分[3]。而目前在啮齿类动物中,还没有在人类中描述的NREM细分标准,慢波睡眠(slow-wave sleep,SWS)是啮齿动物NREM的唯一衡量标准。
运用脑电图/肌电图(EEG/EMG)技术能够测量出啮齿类动物的睡眠潜伏期、睡眠时相图(包含Wake、NREM及REM各个阶段时长)、睡眠波转换次数及占比等相关睡眠指标,这些睡眠参数对于镇静催眠药物的筛选非常重要[4]。理想的促睡眠药物应该能有效减少睡眠潜伏期并延长睡眠时长,且能够恢复到正常状态下的睡眠结构。
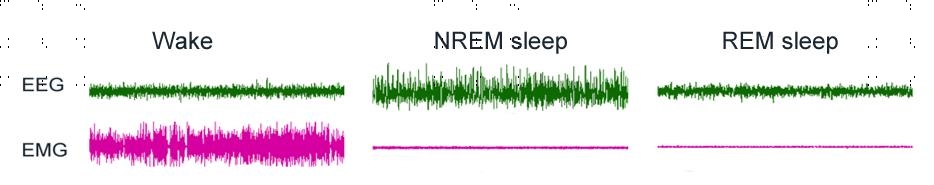
图1. 觉醒、NREM 和 REM睡眠时相的EEG、EMG特征。觉醒期EEG主要表现为14.5-30 Hz低幅高频β波,并伴有显著的EMG活动;NREM期EEG主要表现为0.5-4 Hz低频高幅δ波,有时夹杂9-14 Hz α波,EMG活动降低;REM期EEG以4.5-8.5 Hz θ波为主,EMG活动被抑制。
睡眠是由昼夜节律系统和机体内稳态系统相互作用调节控制。昼夜节律对睡眠-觉醒行为的调节反映外界环境因素对觉醒的需求,睡眠稳态调节反映机体内部因素对睡眠的需求。主要表现为睡眠和觉醒行为随昼夜变化而产生节律性振荡,而睡眠的时长和深度与先前的觉醒时间相关[5]。睡眠-觉醒环路和神经递质对睡眠觉醒的作用是由大脑主要的唤醒系统包括“自下而上”的网状激活系统、边缘网络和“自上而下”的认知系统和睡眠促进区域腹侧视前区和视前正中区相互调控促清醒神经递质和促睡眠神经递质来实现的[6, 7]。
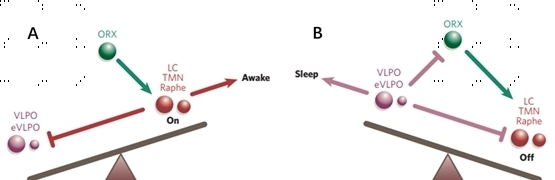
图2. 睡眠和觉醒的大脑核团之间的“跷跷板学说(flip - flop switch)”[8]。(A)在觉醒期间,单胺能神经核(红色)抑制了腹外侧视前核(VLPO;紫色)。(B)在睡眠期间,VLPO神经元的放电会抑制单胺能细胞群。VLPO和单胺能细胞群之间形成了经典的触发开关。英文缩写:LC,蓝斑;TMN,结节乳头体核;VLPO,腹外侧视前核;e VLPO,VLPO 扩展区;ORX,食欲素;Raphe,中缝核。
当前阶段临床治疗失眠障碍的药物主要以苯二氮卓类受体激动剂,褪黑素受体激动剂,食欲素受体拮抗剂和具有催眠效应的抗抑郁药物为主,其相应的靶点如下。
GABAA 受体是一种糖蛋白,由3种不同的亚基组成,与Cl-通道相偶联,除了2个GABA结合位点之外,还具有其他物质的变构结合位点。例如巴比妥类药物并不影响GABA的释放、代谢或重摄入,而是与GABAA受体α亚基上的特定位点结合形成复合物并使其构象发生改变,从而影响复合物中 GABA 配体门控的Cl-通道的传导,延长其开放时间,引起持续的中枢神经抑制[9]。激活GABAA受体活性可以缩短入睡潜伏期,显著改善患者症状,同时改变了睡眠结构,表现为 3 /4 期睡眠和快动眼睡眠的减少,镇静催眠作用较强[10]。
褪黑素是松果体分泌的吲哚类激素,与昼夜节律系统有密切相关。研究表明,褪黑素的分泌呈昼夜节律性,光照通过视交叉上核抑制褪黑素的分泌,日间褪黑素分泌水平低,夜间分泌水平增高[11]。褪黑素参与调节睡眠-觉醒周期,有镇静催眠和调节睡眠觉醒周期的作用。褪黑素受体激动剂类药物主要通过激动褪黑素1受体、褪黑素2受体发挥镇静催眠作用,能够有效治疗失眠,成为睡眠障碍治疗药物中的研究热点。
食欲素(orexin)是一种在下丘脑外侧区域合成和分泌的促进觉醒的神经肽。食欲素受体(orexin receptor)与食欲素结合,可以发挥调节睡眠-觉醒状态的作用。若夜间食欲素分泌过多,会导致觉醒系统过于强大,不能顺利切换成睡眠系统,就会出现失眠[12]。如果能够抑制夜间食欲素的活性或阻断食欲素与食欲素受体的结合,就会抑制食欲素的促清醒作用,减少觉醒信号、增加睡意、恢复正常睡眠节奏[13]。食欲素受体拮抗剂在治疗失眠症方面表现出巨大潜力,已成为近期研究的热点之一。
5-羟色胺 (5-HT) 是一种抑制性神经递质,广泛存在于哺乳动物大脑皮质及神经突触中,其主要功能是促进觉醒和抑制快速眼动睡眠[14]。研究表明,5-HT2A和5-HT2C受体敲除小鼠表现出觉醒显著增加和慢波睡眠减少。阻断 5-HT2A受体可提高睡眠的持续度,减少觉醒、微觉醒及睡眠时相转换的次数,增加慢波睡眠,并具有剂量依赖性[14, 15]。
模拟外界环境刺激,例如触碰、水平台、滚筒、束缚和社会挫败等模拟心理生理压力造成的失眠。
Ø触碰法指通过轻柔触碰动物、晃动或拍打鼠笼以干扰动物的睡眠造成动物失眠的方法[16]。
Ø平台水环境法是指动物进入REM睡眠后肌肉张力消失,从平台掉落水中惊醒,造成REM睡眠剥夺[17]。
Ø滚筒法是将动物放入滚筒等装置中,装置自动旋转,动物被迫随装置转动而运动,导致无法入睡或短暂睡眠后觉醒[18]。
Ø束缚是将动物放入狭小的束缚装置中,限制动物的运动空间和范围,造成心理和生理的双重压力,具有简单易操作、无痛且持久的特点[19]。
Ø慢性社会挫败动物模型模拟人在社会环境中,因社会地位等问题产生的心理压力,最终导致社交恐惧和兴趣缺失[20]。此种物理失眠的方法多会导致焦虑、抑郁等精神类问题,对于研究此类疾病模型,EEG的变化亦是重要标准。
主要是针对特异性靶点,使动物出现失眠症状。
Ø对氯苯丙氨酸(4-chloro-DL-phenylalanine,PCPA) 是色氨酸羟化酶的选择性和不可逆性抑制剂,色氨酸羟化酶是合成 5-HT 的起始酶和限速酶。5-HT 已被证实在睡眠-觉醒的调节中发挥重要作用,而PCPA可有效阻断 95% 以上5-HT合成[21]。该方法造模成功率高,稳定性好,动物出现的失眠症状与人类相似,目前已广泛用于失眠动物实验的研究。
Ø咖啡因诱导失眠模型: 腺苷是一种睡眠稳态的调节药,具有镇静催眠作用。咖啡因是腺苷受体的拮抗药,具有与腺苷相反的作用,可以增加大脑的活跃程度。人和大鼠服用或者注射咖啡因后都会导致睡眠潜伏期延长,REM和NREM减少,并伴有δ活动的降低[22]。
植入式生理信号遥测系统由植入体、接收器、数据转换器和记录分析计算机构成,用于长时间监测清醒无束缚动物的心电、脑电、体温及活动度等生理参数。使用此系统可以保证动物在笼内自由活动,不需要麻醉或束缚,测量的生理信号更能反映自然状态下的动物生理状况[23]。研究表明,持续的脑电图监测对于观察动物疾病状态的发展及药物筛选具有重要作用,同时遥测系统越来越多地被应用于监测自由运动动物的脑电肌电图,为促睡眠药物药效评价提供技术支持[24]。脑电图( EEG) 和肌电图( EMG) 可准确反映睡眠过程,是促睡眠药物药效评估最直接且可靠的评价方法。
爱思益普的促睡眠药物药效评价是基于DSI遥测技术使用连续注射PCPA的方法构造大鼠失眠模型,记录并评估失眠动物模型的睡眠结构变化。脑电图( EEG) 和肌电图( EMG) 可准确反映睡眠过程,为最直接、可靠的评价方法。结果显示,与Control组大鼠相比,Model组NREM和REM时间明显减少,清醒时间显著增加。此外,动物还表现出多动、易怒、攻击性强等异常行为。2mg/kg Estazolam用于验证该模型的预测效度,结果显示,与模型组相比,给予 Estazolam后,NREM和REM时间明显增加,清醒时间显著降低。详见图3和图4。
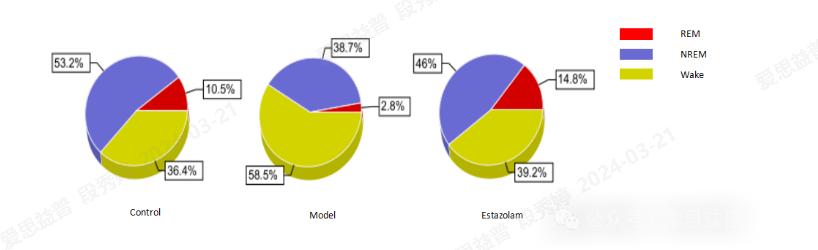
图3. Estazolam增加失眠大鼠的NREM和REM的睡眠时相占比。左面为Control 组,中间为Model组,右面为Estazolam组。
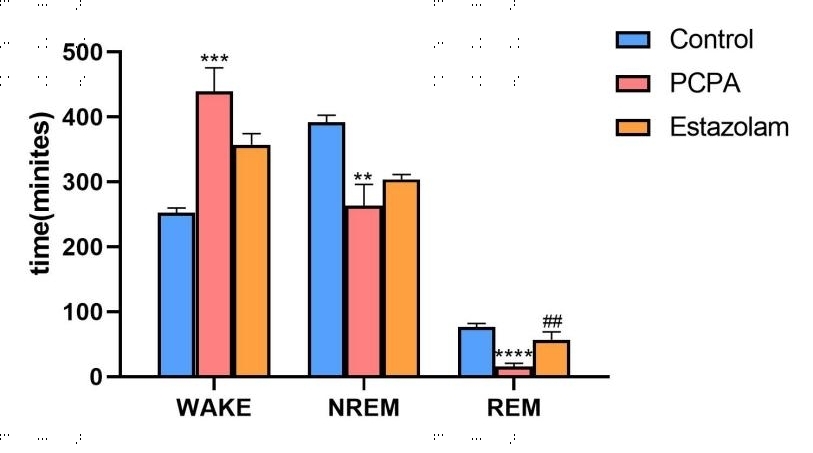
图4. Estazolam增加失眠大鼠的NREM和REM的总睡眠时长。
[1] Cao X L, Wang S B, Zhong B L, et al. The prevalence of insomnia in the general population in China: A meta-analysis[J]. PLoS One, 2017,12(2):e170772.
[2] Kruger J L, Gravett N, Bhagwandin A, et al. Sleep in the Cape Mole Rat: A Short-Sleeping Subterranean Rodent[J]. Brain Behav Evol, 2016,87(2):78-87.
[3] Le Bon O. Relationships between REM and NREM in the NREM-REM sleep cycle: a review on competing concepts[J]. Sleep Med, 2020,70:6-16.
[4] Zhong Y H, Jiang S, Qu W M, et al. Saikosaponin a promotes sleep by decreasing neuronal activities in the lateral hypothalamus[J]. J Sleep Res, 2022,31(2):e13484.
[5] Borbely A. The two-process model of sleep regulation: Beginnings and outlook[J]. J Sleep Res, 2022,31(4):e13598.
[6] Buysse D J. Insomnia[J]. JAMA, 2013,309(7):706-716.
[7] Mendez-Diaz M, Ruiz-Contreras A E, Cortes-Morelos J, et al. Cannabinoids and Sleep/Wake Control[J]. Adv Exp Med Biol, 2021,1297:83-95.
[8] Saper C B, Scammell T E, Lu J. Hypothalamic regulation of sleep and circadian rhythms[J]. Nature, 2005,437(7063):1257-1263.
[9] Uusi-Oukari M, Korpi E R. Regulation of GABA(A) receptor subunit expression by pharmacological agents[J]. Pharmacol Rev, 2010,62(1):97-135.
[10] Dieye A M, Sylla M, Ndiaye A, et al. Benzodiazepines prescription in Dakar: a study about prescribing habits and knowledge in general practitioners, neurologists and psychiatrists[J]. Fundam Clin Pharmacol, 2006,20(3):235-238.
[11] Hardeland R, Poeggeler B, Srinivasan V, et al. Melatonergic drugs in clinical practice[J]. Arzneimittelforschung, 2008,58(1):1-10.
[12] Coleman P J, Gotter A L, Herring W J, et al. The Discovery of Suvorexant, the First Orexin Receptor Drug for Insomnia[J]. Annu Rev Pharmacol Toxicol, 2017,57:509-533.
[13] Snyder E, Ma J, Svetnik V, et al. Effects of suvorexant on sleep architecture and power spectral profile in patients with insomnia: analysis of pooled phase 3 data[J]. Sleep Med, 2016,19:93-100.
[14] Landolt H P, Wehrle R. Antagonism of serotonergic 5-HT2A/2C receptors: mutual improvement of sleep, cognition and mood?[J]. Eur J Neurosci, 2009,29(9):1795-1809.
[15] Monti J M. Serotonin control of sleep-wake behavior[J]. Sleep Med Rev, 2011,15(4):269-281.
[16] Lemons A, Sare R M, Beebe S C. Chronic Sleep Deprivation in Mouse Pups by Means of Gentle Handling[J]. J Vis Exp, 2018(140).
[17] Machado R B, Suchecki D, Tufik S. Comparison of the sleep pattern throughout a protocol of chronic sleep restriction induced by two methods of paradoxical sleep deprivation[J]. Brain Res Bull, 2006,70(3):213-220.
[18] Roman V, Van der Borght K, Leemburg S A, et al. Sleep restriction by forced activity reduces hippocampal cell proliferation[J]. Brain Res, 2005,1065(1-2):53-59.
[19] Buynitsky T, Mostofsky D I. Restraint stress in biobehavioral research: Recent developments[J]. Neurosci Biobehav Rev, 2009,33(7):1089-1098.
[20] Berton O, McClung C A, Dileone R J, et al. Essential role of BDNF in the mesolimbic dopamine pathway in social defeat stress[J]. Science, 2006,311(5762):864-868.
[21] Khanna J M, Kalant H, Le AD, et al. Effect of modification of brain serotonin (5-HT) on ethanol tolerance[J]. Alcohol Clin Exp Res, 1979,3(4):353-358.
[22] Clark I, Landolt H P. Coffee, caffeine, and sleep: A systematic review of epidemiological studies and randomized controlled trials[J]. Sleep Med Rev, 2017,31:70-78.
[23] Chang P, Hashemi K S, Walker M C. A novel telemetry system for recording EEG in small animals[J]. J Neurosci Methods, 2011,201(1):106-115.
[24] Dispersyn G, Sauvet F, Gomez-Merino D, et al. The homeostatic and circadian sleep recovery responses after total sleep deprivation in mice[J]. J Sleep Res, 2017,26(5):531-538.