News Detail
 来源:本站
来源:本站
 浏览量:21333
浏览量:21333

一、SPR平台简介
表面等离子共振(SPR)是一种基于光学、非标记的高度灵敏的技术,能准确分析两种生物分子在结合动力学和亲和力以及结合特异性方面的相互作用,可广泛适用于不同分子,如离子、分子片段、小分子、蛋白质、病毒等。
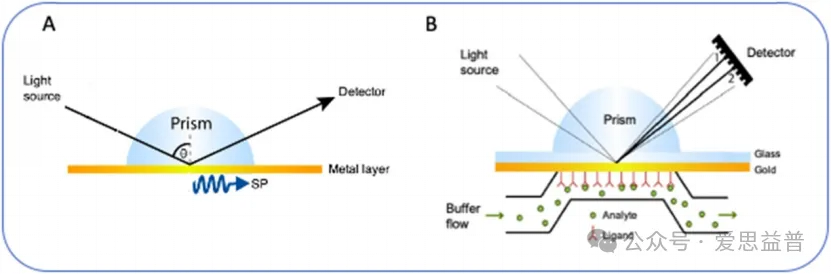
(A) 在一定角度θ下,能量从光传递到表面等离子体中,并发生表面等离子体共振。(B) 当分子结合时,靠近表面的折射率会发生变化,从而引起角度的偏移 (1 → 2)。角度的变化与束缚材料的质量成正比。
二、RAS靶点简介
Kras是一种鼠类肉瘤病毒癌基因,其基因突变出现在近90%的胰腺癌中。在细胞中,RAS蛋白在“ON”和“OFF”之间转换。当RAS和GDP结合时,蛋白处于失活状态;当RAS和GTP结合时,它处于激活状态,可激活下游的信号通路,直接促进了肿瘤细胞的增殖和生存。
虽然KRAS靶点如此至关重要,但是KRAS蛋白是一种无明显凸出,近似球形的结构,无明显结合位点,很难合成靶向结合并抑制其活性的化合物,一度成为“不可成药”靶点。22年AACR会议中,KRAS G12D的抑制剂 MRTX1133对于KRAS G12D的亲和力达到了pM级别。KRAS依旧是目前各大公司关注的一个可成药的“明星”靶点。
三、蛋白的选择
爱思益普已通过E.coli蛋白纯化系统表达纯化出15种不同RAS野生型和突变型的高活性的RAS蛋白。我们针对KRAS蛋白标记了2种不同的标签,His标签和Biotin标签,可以满足基于生化、SPR、LC-MS等不同类型实验的使用。

四、生化的测试
KRAS“ON”实验:基于HTRF进行化合物对KRAS激活状态抑制剂的筛选,KRAS在“ON”状态下会和下游RBD结合,KRAS和RBD蛋白带有不同的标签,当2个蛋白发生相互作用时,加入对应标签的acceptor和donor可检测其蛋白-蛋白相互作用信号,当化合物阻断了KRAS和RBD的相互作用时,信号降低。
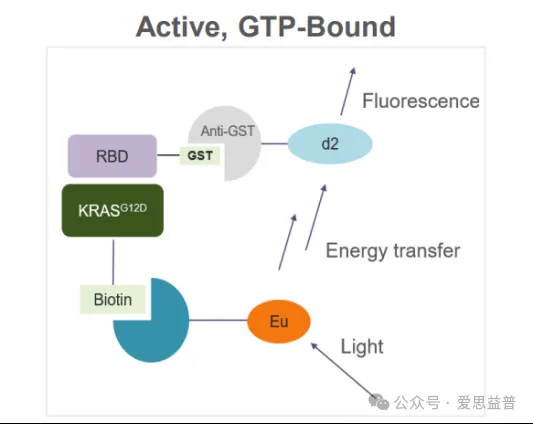
(KRAS “ON”实验原理)
KRAS“OFF”实验:基于TR-FRET进行化合物对KRAS失活状态抑制剂的筛选,目前ICE有2套核苷酸交换实验(NEA)实验,一种是基于体内的信号通过,将KRAS-GDP通过SOS1和GTP转换成KRAS-GTP状态,通过和下游RBD的结合来检查化合物对于KRAS“OFF”状态下的抑制。另外一种如下图所示,我们通过在体系中加入一个标记了BODIPY-GTP来检测实验体系的信号,KRAS-GDP在SOS1的核苷酸交换功能作用下将BODIPY-GTP转移到KRAS上,通过加入KRAS标签donor,可和GTP上的BODIPY形成荧光信号能量转移,产生信号。
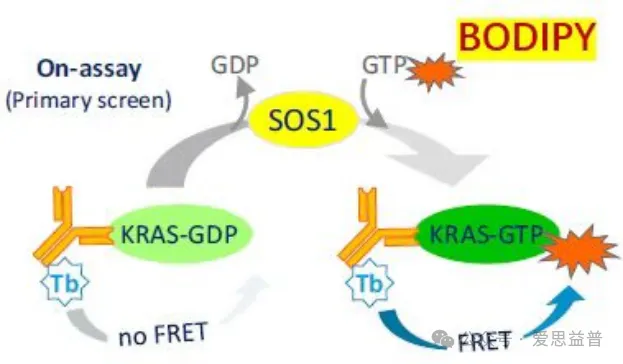
(KRAS “OFF”实验原理)
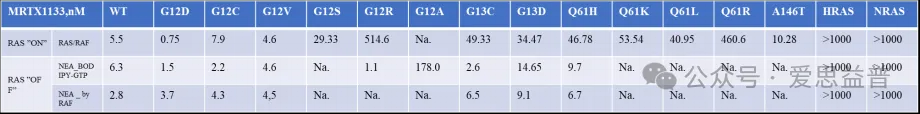
*以上为ICE常规检测结果,具体检测结果以沟通为主
五、SPR的结果和优势
通过SPR技术,使用Biacore 8K仪器测试MRTX1133不同浓度下与KRAS-GMPPNP的亲和力。使用Biacore 8K的分析软件,采用1:1 binding的分析模式对其结合和解离进行分析。MRTX1133在KRAS “ON”状态下亲和力在nM级别,依旧有很好的亲和力。
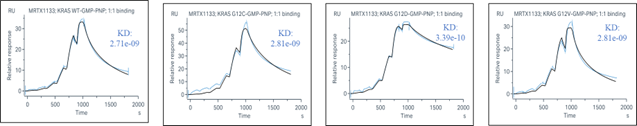
ICE_MRTX1133对不同RAS“ON”的亲和力检测
通过对KRAS蛋白进行GDP loaded,维持KRAS蛋白的“OFF”状态。使用Biacore 8K仪器测试MRTX1133不同浓度下与KRAS-GDP的亲和力,采用1:1 binding的分析模式对其结合和解离进行分析。
基于生化平台受到实验反应条件,蛋白质量等多方面的影响,很难检测到pM级别的化合物;而细胞实验涉及到的细胞内复杂的环境,对于早期化合物的筛选尤其是对于药物在不同靶点上的选择性测试相对复杂;而生物物理平台SPR可以检测到pM级别化合物和靶点蛋白的亲和力,对于具有选择性的高亲和力的化合物筛选来说,是更为准确且快速的筛选途径。SPR检测一直以来都是评估化合物与靶标的亲和力也是行业内的“金标准”。
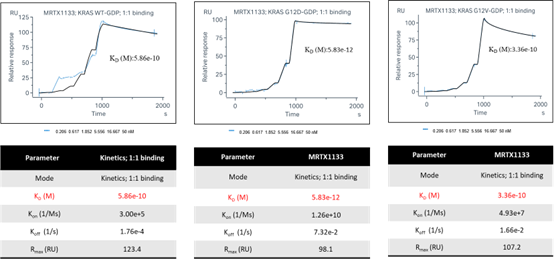
ICE_MRTX1133对不同RAS“OFF”的亲和力检测
爱思益普配备了最先进的Biacore 8K仪器,具有高通量化合物筛选、动力学和亲和力测试、结合特异性分析和抗体表征等能力。
我们可以提供:
SPR亲和力结合测定(适用于任何分析物(小分子、抗体、肽、核酸)和任何靶标(蛋白、酶))


扫一扫关注
爱思益普公众号


业务咨询
北京
业务咨询专线:010-6780-9840
联系地址:北京市经济技术开发区科创十三街18号院锋创科技园16号楼
上海
业务咨询专线:010-6780-9840
联系地址:上海市浦东新区蔡伦路780号新技术推广大楼3E5O室
徐州
业务咨询专线:010-6780-9840
联系地址:江苏省徐州市云龙区淮海文博园 二号楼2层
贵州
业务咨询专线:010-6780-9840
联系地址:贵州省贵阳市南明区龙岭路50号 欧美医药产业园一期2号楼



